
 结构.分子中的四个磷原子位于正四面体的四个顶点.则P4分子中共有
结构.分子中的四个磷原子位于正四面体的四个顶点.则P4分子中共有
 分析;
分析;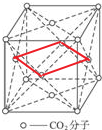 ,则使正方形的四个顶点部落到CO2分子的中心,在这个正方形的平面上有出有4个CO2分
,则使正方形的四个顶点部落到CO2分子的中心,在这个正方形的平面上有出有4个CO2分 可知,P4分子中共有6个P-P键;
可知,P4分子中共有6个P-P键;| 1 |
| 8 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 8 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝粉与硫酸铜溶液的反应 |
| B、氧气与一氧化碳的反应 |
| C、氢气还原氧化铜的反应 |
| D、氢氧化铁与稀硫酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、直线形 sp杂化 |
| B、三角形 sp2杂化 |
| C、三角锥形 sp2杂化 |
| D、三角锥形 sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
48 22 |
50 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等于20% | B、小于20% |
| C、大于20% | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、①③④⑤ |
| C、①②④⑤ | D、②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com