
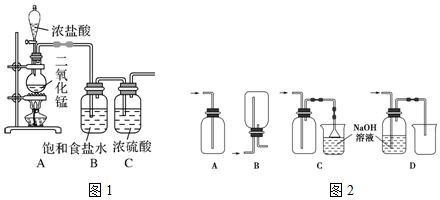
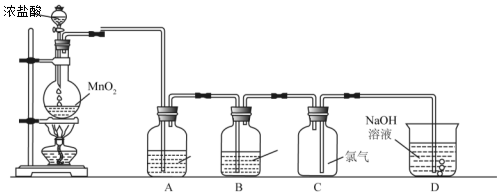
分析 实验室用二氧化锰与浓盐酸加热制备氯气,浓盐酸易挥发,所以制备的氯气中含有氯化氢和水蒸气,依次通过盛有饱和食盐水、浓硫酸的洗气瓶除去杂质,氯气密度大于空气密度,应选择向上排空气法收集,氯气有毒需要进行尾气处理.
(1)依据仪器形状说出其名称;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢、水蒸气,结合氯气、氯化氢在饱和食盐水溶解度及浓硫酸吸水性确定B、C的作用;
(3)氯气是比空气重的可溶于水的有毒气体,依据氯气物理性质和装置分析;
(4)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水;
(5)依据方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O计算生成氯气的物质的量,进而计算标况下气体的体积.
解答 解:(1)图中盛浓盐酸的装置名称为分液漏斗
故答案为:分液漏斗;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢、水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以选择饱和食盐水除去氯气中的氯化氢,浓硫酸具有吸水性,可以干燥氯气;
故答案为:除去Cl2中的HCl;除去Cl2中的H2O;
(3)A只有进气管,没有出气管,易发生爆炸,故A不选;
B.向下排气法收集,适合密度小于空气密度的气体,故B不选;
C.向上排空气法收集,适合密度大于空气密度,氯气密度大于空气密度,故C选;
D.氯气与氢氧化钠反应,不能用排氢氧化钠溶液法收集,故D不选;
故选:C;
(4)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,反应的方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(5)1.74g的二氧化锰物质的量为:$\frac{1.74g}{87g/mol}$=0.02mol,依据方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知反应生成氯气0.02mol,标况下体积为:0.02mol×22.4L/mol=0.448L,即;448mL;
故答案为:448.
点评 本题为实验题,考查了氯气的制备,明确制备原理及氯气的性质是解题关键,注意明确各装置作用,题目难度不大.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:选择题
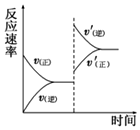 在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )
在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )| A. | 正反应是吸热反应,m+n>p+q | B. | 逆反应是吸热反应,m+n<p+q | ||
| C. | 正反应是吸热反应,m+n<p+q | D. | 逆反应是吸热反应,m+n>p+q |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 +
+ →
→
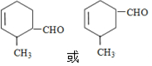 .
.
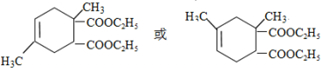 .
.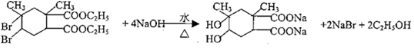 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
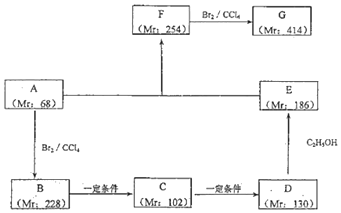
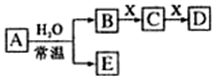 A、B、C、D、E、X均为中学化学常见物质,其中A、B、C、D、E是由短周期元素组成的无机物,它们存在如图转化关系(部分生成物和反应条件略去).请回答下列问题:
A、B、C、D、E、X均为中学化学常见物质,其中A、B、C、D、E是由短周期元素组成的无机物,它们存在如图转化关系(部分生成物和反应条件略去).请回答下列问题: ; B与X反应生成C的离子方程式2OH-+CO2=CO32-+H2O;
; B与X反应生成C的离子方程式2OH-+CO2=CO32-+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
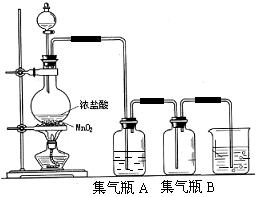 实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O
实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com