
| A. | 甲烷和氯气光照条件下反应,反应类型为取代反应;乙烯可以使溴水褪色,发生加成反应 | |
| B. | 不能用酸性高锰酸钾溶液鉴别乙酸和乙醇 | |
| C. | 乙醇在铜做催化剂并加热条件下生成乙醛,发生催化氧化反应 | |
| D. | 生活中可以用食醋除去水壶中的水垢,主要是利用了食醋中醋酸的酸性 |
分析 A.机化合物分子里的某些原子或原子团被其它原子或原子团所代替的反应是取代反应,有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应;
B.乙醇能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,乙酸不能被酸性高锰酸钾溶液氧化;
C.在铜作催化剂、加热条件下,乙醇被氧化生成乙醛;
D.强酸能和弱酸盐反应生成弱酸.
解答 解:A.甲烷中的H原子被氯原子取代生成氯代烃,该反应属于取代反应;乙烯中碳碳双键断裂,每个C原子分别连接一个溴原子生成1,2-二溴乙烷,该反应属于加成反应,故A正确;
B.乙醇能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,乙酸不能被酸性高锰酸钾溶液氧化,所以二者反应现象不同,可以鉴别,故B错误;
C.在铜作催化剂、加热条件下,乙醇中醇羟基和连接醇羟基的碳原子上分别失去一个氢原子而生成醛基,所以乙醇发生催化氧化反应,故C正确;
D.强酸能和弱酸盐反应生成弱酸,乙酸酸性大于碳酸,所以乙酸能和碳酸钙反应生成可溶性的乙酸钙,该反应是利用乙酸的酸性,故D正确;
故选B.
点评 本题考查有机物鉴别、醇的催化氧化、强酸制取弱酸等知识点,明确物质性质及物质性质的差异性是解本题关键,会利用物质的差异性选取合适试剂鉴别有机物,题目难度不大.


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:解答题
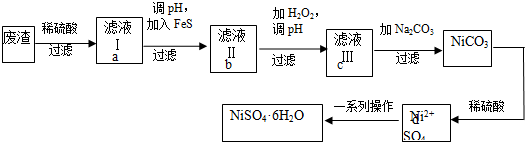
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
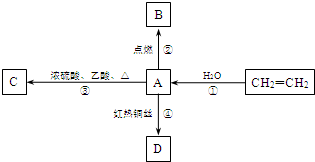 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种转化.
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种转化. CH3COOCH2CH3+H2O,该反应的类型是:取代(或酯化)反应.
CH3COOCH2CH3+H2O,该反应的类型是:取代(或酯化)反应.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-→CH3COO-+H2O | |
| C. | 草酸使高锰酸钾溶液褪色:5H2C2O4+2MnO4-+6H+═2Mn2++10 CO2↑+8H2O | |
| D. | 乙醛溶液与足量的银氨溶液共热CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$ CH3COO-+NH${\;}_{4}^{+}$+2Ag↓+3NH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该化合物中含有的化学键是共价键、离子键.
,该化合物中含有的化学键是共价键、离子键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com