
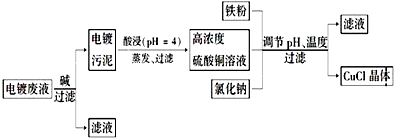
分析 电镀废液中加入碱可生成Cu(OH)2、Fe(OH)3沉淀,在pH约为4时,用酸浸得到硫酸铜溶液和氢氧化铁沉淀,在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl,发生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+,最后所得滤液为硫酸亚铁,结合CuCl的性质和题目要求解答该题.
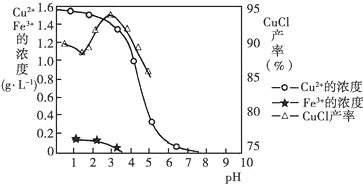
(1)在pH约为4时,用酸浸得到硫酸铜溶液和氢氧化铁沉淀,说明氢氧化铜被酸溶解,由图2可知,析出CuCl沉淀的最佳pH应为CuCl的产率最大,且氢氧化铁杂质较少,应约为3左右;
(2)在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl,发生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+,故答案为:2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;
(3)由题给信息可知CuCl微溶于水,不溶于乙醇,在空气中会被迅速氧化,为防止氧化应隔绝空气,在干燥、真空环境中可加快乙醇和水的蒸发;
(4)产品滤出时所得滤液的主要分成是Na2SO4和FeSO4;获取FeSO4•7H2O晶体,还需要知道的是硫酸钠和硫酸亚铁溶解度随温度的变化的情况;
(5)若将铁粉换成亚硫酸钠是亚硫酸钠作为还原剂,失电子,反应方程式为:2 CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2 Na2SO4+H2SO4,加入稀碱溶液消耗氢离子,从平衡正向移动,有利于氯化亚铜的产生,而当氢氧根离子浓度大到一定程度时以达到氢氧化铜的溶度积分析解答.
解答 解:(1)在pH约为4时,用酸浸得到硫酸铜溶液和氢氧化铁沉淀,说明氢氧化铜被酸溶解,反应的离子方程式为Cu(OH)2+2H+=Cu2++2H2O,由图2可知,析出CuCl沉淀的最佳pH应为CuCl的产率最大,且氢氧化铁杂质较少,应约为3左右,
故答案为:Cu(OH)2+2H+=Cu2++2H2O;3;
(2)在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl,发生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+,
故答案为:2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;
(3)由题给信息可知CuCl微溶于水,不溶于乙醇,在空气中会被迅速氧化,为防止氧化应隔绝空气,在干燥、真空环境中可加快乙醇和水的蒸发,
故答案为:加快乙醇和水的蒸发,防止CuCl被空气氧化;
(4)产品滤出时所得滤液的主要分成是Na2SO4和FeSO4;获取FeSO4•7H2O晶体,还需要知道的是硫酸钠和硫酸亚铁溶解度随温度的变化的情况,
故答案为:Na2SO4和FeSO4;不同温度下硫酸钠和硫酸亚铁的溶解度;
(5)亚硫酸钠作为还原剂,失电子,发生氧化还原反应,反应方程式为:2 CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2 Na2SO4+H2SO4,加入稀碱溶液消耗氢离子,从平衡正向移动,有利于氯化亚铜的产生,而当氢氧根离子浓度大到一定程度时以达到氢氧化铜的溶度积,所以又析出氢氧化铜,所以调节pH至3.5,
故答案为:2CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2 Na2SO4+H2SO4;OH-中和了反应中的H+,有利于平衡向右移动,提高CuCl的产率.但当OH-浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜,从而降低了CuCl的产率.
点评 本题考查制备方案的设计,侧重于学生的分析能力和实验能力的考查,注意把握题给信息,答题时注意审题,把握自学能力的培养,难度中等.


科目:高中化学 来源: 题型:解答题
 汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.
汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| CO2(g) | H2(g) | H2O(g) | CO2(g) | |||
| 1 | 650 | 2 | 1 | 0.4 | 1.6 | 6 |
| 2 | 900 | 4 | 2 | 1.6 | 2.4 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 惰性电极电解硝酸银溶液不可能在电极上生成银,因为银可以溶于硝酸 | |
| B. | 25℃,惰性电极电解氢氧化钠溶液,溶液PH不变,因为实质是电解水 | |
| C. | 惰性电极电解足量硫酸铜溶液一段时间加入氧化铜固体可使电解质恢复到电解前 | |
| D. | 惰性电极电解淀粉碘化钾溶液,可看到阴极区域溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
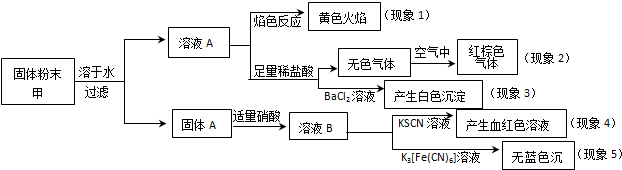
| A. | 根据现象1可推出该固体粉末中含有钠元素,但一定不含钾元素 | |
| B. | 根据现象2可推出该固体粉末中一定不含有NaNO2 | |
| C. | 根据现象3可推出该固体粉末中一定含有Na2SO4 | |
| D. | 根据现象4和现象5可推出该固体粉末中一定不含FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每转移0.1mol电子,理论上生成20.7g Pb | |
| B. | 常温时,在正负极间接上电流表或检流计,指针不偏转 | |
| C. | 正极反应式:Pb2++2e-═Pb | |
| D. | 放电过程中,Li+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应物的键能总和比生成物的键能总和高 | |
| B. | E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 | |
| C. | 正反应的热效应为△H=E1-E2,且E2>E1,所以正反应为放热反应 | |
| D. | 使用合适的催化剂能同时降低E1和E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | X分子中有2个手性碳原子 | |
| B. | Y分子中所有原子可能在同一平面内 | |
| C. | 可用FeCl3溶液或NaHCO3溶液鉴别X和Y | |
| D. | 在NaOH溶液中,1molM最多可与5molNaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LNO2分子总数小于0.1NA | |
| B. | 50ml,18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA | |
| D. | 6.8g液态KHSO4中含有0.1NA个阳离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com