
已知钡的某种同位素是 ,由学过的知识无法推断出的信息是
,由学过的知识无法推断出的信息是
A.钡元素的相对原子质量 B.钡元素在周期表中的位置
C.钡原子的核电荷数 D.钡原子的核外电子排布
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源:2014-2015学年浙江省高三1月份阶段测试化学试卷(解析版) 题型:选择题
S2Cl2在合成橡胶、硬水软化等方面有着重要应用。将Cl2通入熔融的硫磺可制得S2Cl2,S2Cl2是黄红色油状发烟液体,遇水分解出无色有刺激性气味的气体,且溶液变浑浊。有关叙述正确的是
A.在周期表中,氯元素位于硫元素之后,所以Cl2的氧化性弱于硫单质
B.Cl2与硫磺的反应中,S2Cl2只是氧化产物
C.在常温常压下,硫磺是原子晶体,S2Cl2是分子晶体
D.S2Cl2与水反应时,既体现氧化性又体现还原性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市普高高三上学期第一次诊断理综化学试卷(解析版) 题型:选择题
下述实验能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 准确称取氯化钾固体,放入到100mL的容量瓶中,加水溶解,振荡摇匀,定容 | 配制100mL一定浓度的氯化钾溶液 |
B | 下层液体从分液漏斗下端口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 | 取出分液漏斗中所需的上层液体 |
C | 向盛有沸水的烧杯中滴加FeCl3饱和溶液继续加热至溶液呈红褐色 | 制备Fe(OH)3胶体 |
D | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支试管加入少量MnO2 | 研究催化剂对H2O2分解速率的影响 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:选择题
可用下图所示装置制取、干燥、收集并吸收多余气体的是
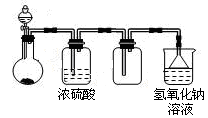
A.浓氨水与氧化钙固体反应制氨气
B.稀硫酸与硫化亚铁固体反应制硫化氢
C.浓盐酸与次氯酸钙固体反应制氯气
D.饱和食盐水与电石反应制乙炔
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:选择题
将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃而加入少量无水硫酸铜,在这两种情况下均保持不变的是
A.硫酸铜的溶解度 B.溶液的质量
C.溶液中溶质的质量分数 D.溶液中Cu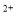 的数目
的数目
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:选择题
生活处处有化学,下列说法正确的是
A.氢氧化铝可作胃酸过多的中和剂
B.福尔马林可作食品的保鲜剂
C.用聚乙烯塑料代替聚乳酸塑料可减少白色污染
D.煎炸食物的花生油、牛油都属于可皂化的饱和酯类
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:填空题
(本题共12分)氨是一种重要的化工产品。“一氧化碳变换”是合成氨原料气生产中的重要环节,其反应方程式为:CO(g) + H2O(g) CO2(g) + H2(g)
CO2(g) + H2(g)
完成下列填空:
23.恒温恒容条件下,能说明该反应达到平衡状态的是 (填字母序号)。
a.ν(CO)消耗 = ν(H2O)生成 b.c(CO2) = c(CO)
c.混合气体的总压不再改变 d.混合气体的密度不再改变
24.将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | CO2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 5 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 650 | 2 | 1 | A | B | t |
①实验1中从反应开始到达到平衡,以H2的浓度变化表示的反应速率为 。
②A = 。
③平衡常数:K(900℃) K(650℃) (填“>”、“<”或“=”=)。
25.温度是一氧化碳变换中最重要的工艺条件,实际生产过程中将温度控制在400℃左右,可能的原因是 。
26.C、H、O、N元素中,核外电子占据5个不同轨道的原子,其最外层电子排布式是 。这四种元素形成的化合物 (填“一定是”、“一定不是”、“不一定是”)离子化合物。
27.能证明碳的非金属性比硅强的事实是 (选填编号)。
a.酸性:H2CO3强于H2SiO3 b.高温下SiO2与C生成Si和CO
c.键的极性:C-H > Si-H d.熔点:金刚石 > 单晶硅
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:选择题
甲烷与四氯化碳分子的空间构型相同,有关两者的比较中正确的是
A.甲烷与四氯化碳分子都是含有极性键的极性分子
B.甲烷与四氯化碳分子内的键角均为600
C.甲烷沸点低于四氯化碳,因为C—H键键长比C—Cl键短
D.甲烷分子比四氯化碳稳定,因为C—H键键能比C—Cl键大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:填空题
(本题共12分)元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
23.与氯元素同族的短周期元素的原子,其核外能量最高的电子所处的电子亚层是 ;
24.碘元素在元素周期表中的位置是 ;为防缺碘,食盐中常添加碘酸钾,该物质内存在 键(填化学键类型)。
25.溴单质是唯一常温下呈液态的非金属单质,它的电子式是 ;液溴的保存通常采取的方法是 。
26.通过比较___________或________________可以判断氯、溴两种元素非金属性强弱。
27.工业上,通过如下转化可制得KClO3晶体:

①配平I中反应的总化学方程式,并标出电子转移的方向和数目:
□NaCl + □H2O 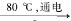 □NaClO3 + □
□NaClO3 + □
②II反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
28.CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com