
| A. | ①③④⑤ | B. | ②③④⑤ | C. | ①②④⑤ | D. | ①②③④ |
分析 ①氧化铝具有很高的熔点;
②氧化铁俗称铁红,是一种红棕色的物质;
③硅酸钠具有粘性,用来制备硅胶;
④明矾净水的原理是铝离子水解形成氢氧化铝胶体,从而吸附水中的颗粒悬浮物;
⑤石灰石的主要成分是碳酸钙,高岭石的主要成分是硅酸盐.
解答 解:①氧化铝具有很高的熔点,是一种比较好的耐火材料,可用来制造耐火坩埚,故①正确;
②氧化铁俗称铁红,常用作红色油漆和涂料,故②正确;
③硅酸钠具有粘性,用来制备硅胶和木材防火剂的原料,故③正确;
④明矾电离出的铝离子水解形成氢氧化铝胶体,从而吸附水中的颗粒悬浮物,故④正确;
⑤石灰石的主要成分是碳酸钙,高岭石的主要成分是硅酸盐,石英和水晶的主要成份都是SiO2,故⑤错误.
故选D.
点评 本题主要考查物质的性质、组成以及用途,是一道基础知识题目,难度不大,可以根据所学知识进行.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| B. | 升高温度,逆反应速率加快,正反应速率减慢 | |
| C. | 升高温度,正、逆反应速率都加快,反应放出的热量不变 | |
| D. | 改变压强,平衡不发生移动,反应放出的热量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 太阳能 | B. | 煤 | C. | 天然气 | D. | 酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液中,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 称量氢氧化钠固体时,将氢氧化钠固体放在垫有滤纸的托盘 | |
| C. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| D. | 称量时,砝码应放在托盘天平的右盘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密度 | B. | 原子数 | C. | 质量 | D. | 分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾、氯化铁晶体常用于净水或消毒 | |
| B. | 实验室通常使用热的纯碱溶液去除油污 | |
| C. | 实验室配制FeCl3溶液时加入少量稀盐酸 | |
| D. | 加热稀醋酸溶液其pH稍有减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
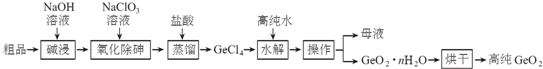
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com