
氨的工业合成工艺的成熟推动了人类文明的进步,不少科技工作者为了寻找廉价的氨的制备方法,进行了前赴后继的探索性工作。请回答下列各题:
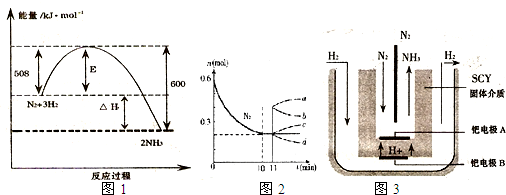
(1)用氢气和氮气合成氨是一个可逆反应,化学方程式如下:N2(g)+3H2(g) ![]() 2NH3(g)。已知,在常温下,1g H2完全转化为NH3,放出的热量为15.4kJ。
2NH3(g)。已知,在常温下,1g H2完全转化为NH3,放出的热量为15.4kJ。
①请写出该反应的热化学方程式 。常温下,将10mol N2和30mol H2放入合成塔中,放出的热量 (填“大于”或“大于”或“小于”)924 kJ
②如果一个反应的△H-T△S<0,则该反应能够自发进行。已知该反应的△S=-198.2J?K-1?mol-1。请判断上述氨气的合成反应在常温下 (填“能”或“不能”)自发进行。(2)Marnellos和Stoukides发明了电化学制备氨气方法,该方法用SCY陶瓷将阳极和阴极隔开,SCY陶瓷具有高质子导电性,其作用是传递H这种方法实现了高温常压下高转化率的电化学合成氨。已知阳极发生的电极反应为:H2→2H++2e-。则阴极的电极反应为 。
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 500℃ |
| 1000℃ |
| 1000℃ |
| x | y | z |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市黄浦区高三上学期期末教学质量调研化学试卷(解析版) 题型:计算题
纯碱是主要的化工原料,化学家发明了其不同的工业制法,其中法国化学家尼古拉斯·勒布朗早在1791年发明的工业合成碳酸钠的方法,简称勒布朗制碱法。该方法包括以下两个阶段:首先从原料氯化钠与浓硫酸在高温下的反应得到中间产物硫酸钠,然后通过硫酸钠与木炭和碳酸钙的反应来得到碳酸钠。各步骤反应的化学方程式如下:
2NaCl+H2SO4 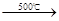 Na2SO4+2HCl↑
Na2SO4+2HCl↑
Na2SO4+2C
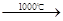 Na2S+2CO2↑
Na2S+2CO2↑
Na2S+CaCO3 Na2CO3+CaS
Na2CO3+CaS
完成下列计算(计算过程保留3位有效数字)
(1)假设每一步反应物的量足够,反应完全,理论上每获得1kg纯度为80%的纯碱需要氯化钠的的质量是_________kg。
(2)步骤②碳单质过量时也同样可以反应获得Na2S,此时所发生的反应的化学方程式是___________________________________。若其它条件不变,步骤②按此反应进行,每获得1kg纯度为80%的纯碱需要氯化钠的的质量是__________kg,此时消耗碳单质的量是原步骤②反应用碳量的____倍。
(3)通过定性分析,勒布朗制碱法获得的纯碱含有杂质CaCO3和CaS,为了测定产品纯度,取10g样品与稀硝酸反应,硫元素全部转化成淡黄色固体,称量其质量为0.16g,另取10g样品与稀盐酸反应,得到气体(忽略气体在水中的溶解),折算为标况下,体积为2.162L,计算求出该产品中Na2CO3的纯度。
(4)若除氯化钠和碳单质的量外,其它反应物足量,反应充分, 如果加入amol氯化钠时,生成的Na2CO3为yg,电子转移数为zmol,讨论分析当氯化钠与碳的物质的量之比x的值不同时,用函数式表示y和z的值是多少。
|
x |
y |
z |
|
|
|
|
|
|
|
|
|
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
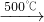 Na2SO4+2HCl↑
Na2SO4+2HCl↑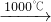 Na2S+2CO2↑
Na2S+2CO2↑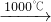 Na2CO3+CaS
Na2CO3+CaS| x | y | z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com