
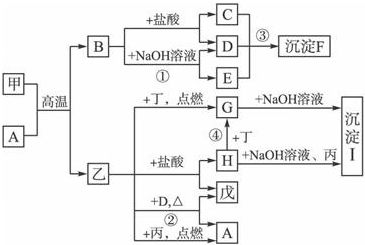
 在一定条件下可实现图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其他字母表示化合物.
在一定条件下可实现图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其他字母表示化合物. ,故答案为:Fe3O4;
,故答案为:Fe3O4; ;
;
| ||
| ||


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
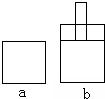 如图所示两个极易导热的密闭容器a和b,容器a体积恒定,容器b体积可变,在起始温度、体积相等的条件下,按下列两种情况投料.
如图所示两个极易导热的密闭容器a和b,容器a体积恒定,容器b体积可变,在起始温度、体积相等的条件下,按下列两种情况投料.| A、反应起始时,两容器内反应速率va和vb的关系为:va=vb |
| B、反应过程中,两容器内反应速率va和vb的关系为:va<vb |
| C、反应达平衡时,两容器内反应物的转化率αa和αb的关系为:αa<αb |
| D、反应达平衡时,两容器内压强Pa和Pb的关系为:Pa>Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯酸钾、碳单质、液态氯化钠、液氨、王水 |
| B、双氧水、稀有气体、碱式碳酸镁、硫酸铜溶液、明矾 |
| C、烧碱、纯碱、火碱、天然气、乙酸 |
| D、二氧化锰、硫单质(S8)、NH3?H2O、纯净空气、H2O和D2O组成的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、NH4+、SO42-、NO3- |
| B、Ca2+、Al3+、HCO3-、Cl- |
| C、MnO4-、K+、SO42-、Na+ |
| D、Na+、Fe2+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:
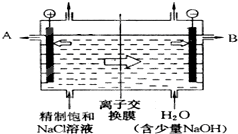 工业上电解制烧碱的技术是用离子交换膜法,主要原料是饱和食盐水.如图为离子交换膜法电解原理示意图:
工业上电解制烧碱的技术是用离子交换膜法,主要原料是饱和食盐水.如图为离子交换膜法电解原理示意图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com