
某市对大气进行监测,发现首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。将PM2.5样本用蒸馏水处理制成溶液,该溶液中所含水溶性无机离子的浓度如下表:
离子 | K+ | Na+ | NH4+ | H + | SO42- | NO3- | Cl- |
浓度/mol·L-1 | 4×10-6 | 6×10-6[ | 2×10-5 | x | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断H+ 的浓度为 mol·L-1
A.1×10-5 mol·L-1 B.3×10-5 mol·L-1
C.6×10-5 mol·L-1 D.1×10-4mol·L-1
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
下列四种化学实验操作名称从左到右分别是
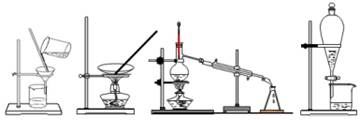
A. 过滤、蒸发、蒸馏、萃取 B. 过滤、蒸馏、蒸发、萃取
C. 蒸发、蒸馏、过滤、萃取 D. 萃取、蒸馏、蒸发、过滤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:选择题
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些 昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)
昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g) COS(g)+H2(g) K=0.1反应前CO物质
COS(g)+H2(g) K=0.1反应前CO物质 的量为10 mol,平衡后CO物质的量为8 mol。下列说法正确的是
的量为10 mol,平衡后CO物质的量为8 mol。下列说法正确的是
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.CO的平衡转化率为80%
D.反应前H2S物质的量为7 mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:填空题
(易混易错题组)有关物质的量浓度的计算
(1)将4gNaOH固体溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为_________mol/L。取出10mL此溶液,其中含有NaOH_________g。将取出的溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为_________mol/L。

(2)如图实验室某浓盐酸试剂瓶标签上的有关数据,据此计算:该浓盐酸中HCl的物质的量浓度为__________mol/L;用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸。需要量取___________mL上述浓盐酸进行配制。
(3)100mL0.3mol/LNa2SO4溶液和50mL0.2mol/LAl2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为__________mol/L
(4)标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1L水(密度1 g/cm3)中,所得溶液的密度为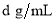 ,则此溶液的物质的量浓度为 mol/L
,则此溶液的物质的量浓度为 mol/L
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度进行实验.请填写下列空白:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度进行实验.请填写下列空白:实验编号 | NaOH溶液的浓度/(mol•L-1) | 滴定完成时,NaOH溶液滴入的体积/mL | 待测盐酸的体积/mL |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com