
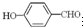
 沸点比
沸点比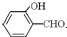 高,原因是
高,原因是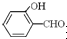 形成分子内氢键,而
形成分子内氢键,而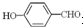 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大. 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.| 224 |
| aNA |
| 224 |
| aNA |
| m |
| ρ |
 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大;
形成分子间氢键,分子间氢键使分子间作用力增大;| 56g/mol |
| NA/mol |
| 56 |
| NA |
| 56 |
| NA |
| 224 |
| NA |
| m |
| V |
| m |
| ρ |
| 224 |
| NA |
| 224 |
| aNA |
| 224 |
| aNA |
| 224 |
| aNA |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
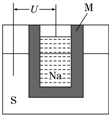 (1)(2011?江苏高考,节选)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:
(1)(2011?江苏高考,节选)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com