
【题目】金属Co、Ni性质相似,在电子工业以及金属材料上应用十分广泛.现以含钴、镍、铝的废渣(含主要成分为CoO、Co2O3、Ni、少量杂质Al2O3)提取钴、镍的工艺如下:
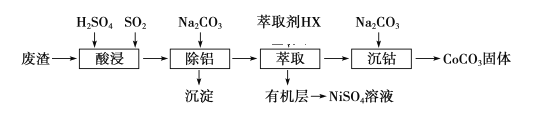
(1)酸浸时SO2的作用是___________________________________。
(2)除铝时加入碳酸钠产生沉淀的离子反应_________________________________。
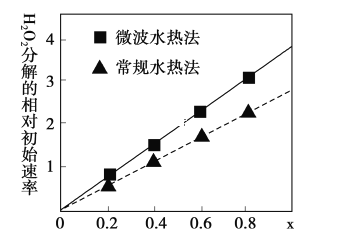
(3)用CoCO3为原料采用微波水热法和常规水热法均可制得H2O2分解的高效催化剂CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价).如图是用两种不同方法制得的CoxNi(1-x)Fe2O4 在10℃时催化分解6%的H2O2 溶液的相对初始速率随x 变化曲线.
①H2O2 的电子式_________________________________。
②由图中信息可知:_________________________________法制取的催化剂活性更高。
③Co2+ 、Ni2+ 两种离子中催化效果更好的是_________________________________。
(4)已知煅烧CoCO3时,温度不同,产物不同.在400℃充分煅烧CoCO3,得到固体氧化物的质量2.41g,CO2的体积为0.672L(标况下),则此时所得固体氧化物的化学式为____________。
【答案】还原剂或将Co3+还原为Co2+ 2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ ![]() 微波水热 Co2+ Co3O4
微波水热 Co2+ Co3O4
【解析】
第一步酸浸,将氧化物全部变为离子,加入的![]() 具有还原性,可将
具有还原性,可将![]() 还原为
还原为![]() ,第二步加入的碳酸钠,
,第二步加入的碳酸钠,![]() 和
和![]() 可以发生双水解反应,将铝变为沉淀除去,接下来用萃取剂除去镍,此时溶液中只剩下
可以发生双水解反应,将铝变为沉淀除去,接下来用萃取剂除去镍,此时溶液中只剩下![]() ,再加入
,再加入![]() 将
将![]() 转变为
转变为![]() 沉淀即可,本题得解。
沉淀即可,本题得解。
(1)根据分析,![]() 作还原剂;
作还原剂;
(2)根据分析,![]() 和
和![]() 发生双水解反应
发生双水解反应![]() ;
;
(3)①画出过氧化氢的电子式即可![]() ;
;
②根据题图可以看出微波水热法具有更高的反应速率;
③当x增大,催化剂中的![]() 比例增大,
比例增大,![]() 比例减小,而x增大时过氧化氢的分解速率也在增大,说明
比例减小,而x增大时过氧化氢的分解速率也在增大,说明![]() 的催化效果更好;
的催化效果更好;
(4)首先根据![]() 算出
算出![]() 的物质的量,根据碳原子守恒可知碳酸钴的物质的量也为0.03mol,再根据钴原子守恒,2.41g固体中有0.03mol钴原子,剩下的全为氧原子,解得氧原子的物质的量为0.04mol,因此所得固体氧化物的化学式为
的物质的量,根据碳原子守恒可知碳酸钴的物质的量也为0.03mol,再根据钴原子守恒,2.41g固体中有0.03mol钴原子,剩下的全为氧原子,解得氧原子的物质的量为0.04mol,因此所得固体氧化物的化学式为![]() 。
。


科目:高中化学 来源: 题型:
【题目】我国是世界上最早制得和使用铜、锌的国家,铜、锌及其化合物在日生产和生活中有着广泛的应用。回答下列问题:
(1)Cu在元素周期表中位于 _____(选填“s” “p” “d”或“ds” )区。在高温下CuO能分解生成Cu2O,试从原子结构角度解释其原因______________。
(2)Cu2+能与吡咯(![]() )的阴离子(
)的阴离子(![]() )形成双吡咯铜。
)形成双吡咯铜。
①![]() 中C和N原子的杂化均为________,1mol
中C和N原子的杂化均为________,1mol![]() 含有_____molσ键。
含有_____molσ键。
②双吡咯铜Cu(![]() )2中含有的化学键有_____(填编号)。
)2中含有的化学键有_____(填编号)。
A 金属键 B 极性键 C 非极性键 D 配位键 E 氢键
③噻吩(![]() )的沸点为84℃,吡咯(
)的沸点为84℃,吡咯( ![]() )的沸点在129 ~131℃之间,吡咯沸点较高,其原因是________。
)的沸点在129 ~131℃之间,吡咯沸点较高,其原因是________。
④分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成的大
表示,其中m代表参与形成的大![]() 键原子数,n 代表参与形成的大
键原子数,n 代表参与形成的大![]() 键电子数(如苯分子中的大
键电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则
),则![]() 中的大
中的大![]() 键应表示为_______。
键应表示为_______。
(3)硼氢化锌[Zn ( BH4 )2 ]常用作有机合成中的还原剂,BH4-的VSEPR模型为______,与其互为等电子体的分子和阳离子有______(各写一种)。
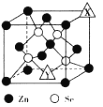
(4)硒化锌(ZnSe)是一种半导体材料,其晶胞结构如图所示,图中X和Y点所堆积的原子均为______(填元素符号);该晶胞中硒原子所处空隙类型为 _____(填“立方体”、 “正四面体”或“正八面体” ) ;若该晶胞的参数为a pm, NA代表阿伏加德罗常数的数值,则晶胞的密度为_____ gcm-3(用相关字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料尼龙 66 具有良好的抗冲击性、韧性、耐燃油性和阻燃、绝缘等特点,因此广泛应 用于汽车、电气等工业中。以下是生产尼龙 66 的一些途径。
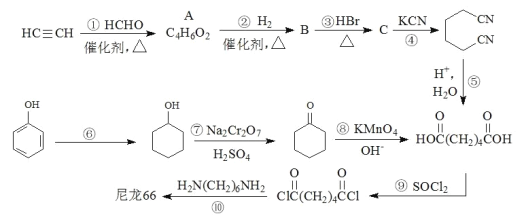
已知:连接在 C≡C 碳原子上的氢原子比较活泼,在催化剂作用下碳氢键易断裂。
(1)A 的结构简式为__________________________。
(2)B 中官能团的名称是__________________________。
(3)反应①~④中,属于加成反应的有__________________________,反应⑥~⑨中,属于氧化反应的有__________________________。
(4)请写出反应⑥的化学方程式__________________________。
(5)高分子材料尼龙 66 中含有![]() 结构片段,请写出反应⑩的化学方程式_____________________。
结构片段,请写出反应⑩的化学方程式_____________________。
(6)某聚合物 K 的单体与 A 互为同分异构体,该单体核磁共振氢谱有三个峰,峰面积之比为 1:2:3,且 能与 NaHCO3 溶液反应,则聚合物 K 的结构简式是__________________________。
(7)聚乳酸(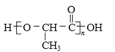 )是一种生物可降解材料,已知羰基化合物可发生下述反应:
)是一种生物可降解材料,已知羰基化合物可发生下述反应:![]() (R′可以是烃基或 H 原子)。用合成路线图表示用乙醇 制备聚乳酸的过程。__________________________
(R′可以是烃基或 H 原子)。用合成路线图表示用乙醇 制备聚乳酸的过程。__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向10 mL 0.1 mol·L-1一元弱碱XOH溶液中逐滴滴加0.1 mol·L-1的盐酸,溶液的AG[AG=lg![]() ]变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是( )
]变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是( )
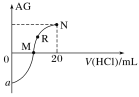
A.若a=-8,则Kb(XOH)≈10-6
B.M点表示盐酸和XOH恰好完全反应
C.R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D.M点到N点,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3、和FeO)得到绿矾(FeSO4·7H2O),在通过绿矾制备铁黄[FeO(OH)]的流程如下:
![]()
已知:FeS2和铁黄均难溶于水
下列说法不正确的是
A. 步骤①,最好用硫酸来溶解烧渣
B. 步骤②,涉及的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
C. 步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D. 步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题:
(1)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为________。
(2)用如图装置可以测定混合气中ClO2的含量:
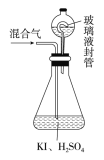
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用0.1000mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为__________,反应中ClO2为_______剂(氧化或还原)。
②玻璃液封装置的作用是__________。
③Ⅴ中加入的指示剂通常为________,滴定至终点的现象是___________。
④测得混合气中ClO2的质量为________g。
(3)用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是________(填标号)。
a明矾b碘化钾c盐酸d硫酸亚铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X与Y可形成化合物![]() ,2元素可形成负一价离子。下列说法正确的是( )
,2元素可形成负一价离子。下列说法正确的是( )
A.X元素基态原子的电子排布式为![]()
B.X元素是第4周期第VA族元素
C.Y元素原子的轨道表示式为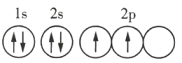
D.Z元素的单质Z2在氧气中不能燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年为“国际化学元素周期表年”。如图所示是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法不正确的是
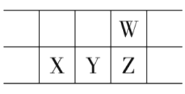
A.原子半径:W<X
B.气态氢化物热稳定性:Z<W
C.Y单质可用做半导体材料
D.X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴、铁、镓、砷的单质及其化合物在生产生活中有重要的应用。回答下列问题:
(1)写出 As 的基态原子的电子排布式_____。
(2)将 NaNO3 和 Na2O 在一定条件下反应得到一种白色晶体,已知其中阴离子与 SO42-互为等 电子体,则该阴离子的化学式是_____。
(3)Fe3+、Co3+与 N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验 Fe2+,配体 CN-中碳原子杂化轨道类型为_____。
②[Co(N3)(NH3)5]SO4 中 Co 的配位数为_____,其配离子中含有的化学键类型为___(填离子键、共价键、配位键)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com