
| A、向碳酸钠溶液中滴加少量醋酸:2CH3COOH+CO32-═2CH3COO-+CO2↑+H2O |
| B、向次氯酸钠溶液中通入少量CO2:2ClO-+H2O+CO2═2HClO+CO32- |
| C、向醋酸清洗水垢后氢氧化镁:2CH3COOH+Mg(OH)2═Mg2++2CH3COO-+2H2O |
| D、向漂白粉溶液中通入少量的SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
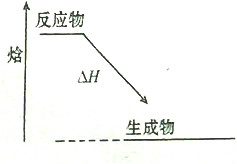
| A、① | B、④ | C、①③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
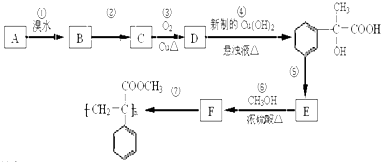
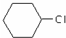 为原料合成重要的化工产品
为原料合成重要的化工产品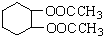 ,写出相应的合成路线流程图(无机试剂任用)
,写出相应的合成路线流程图(无机试剂任用)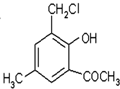 的同分异构体的结构简式:
的同分异构体的结构简式:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2ml | B、3ml |
| C、4ml | D、5ml |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCO3与HCl反应:2H++CaCO3=Ca2++CO2↑+H2O |
| B、Ba(OH)2中滴加H2SO4:Ba2++SO42-=BaSO4↓ |
| C、NaHCO3溶液滴加NaOH溶液:HCO3-+OH-=CO32-+H2O |
| D、CH3COOH与NaOH反应:CH3COOH+OH-=CH3COO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Al3+、Cl-、CO32- |
| B、H+、Na+、Br-、SiO32- |
| C、Na+、Fe2+、SO42-、NO3- |
| D、K+、NH4+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱电解质 | H2CO3 | NH3?H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
| A、c (NH4+)>c (CO32-)>c (NH3?H2O)>c (HCO3-) |
| B、c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+2 c(CO32-) |
| C、c (CO32-)+c (HCO3-)+c (H2CO3)=0.1 mol?L-1 |
| D、c (NH4+)+c (NH3?H2O)=2 c (CO32-)+2c (HCO3-)+2 c (H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com