
【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH![]() CH3COO-+H+ ΔH1>0 (K1=1.75×10-5)
CH3COO-+H+ ΔH1>0 (K1=1.75×10-5)
CH3COO-+H2O![]() CH3COOH+OH- ΔH2>0 ( K2=5.71×10-10 )
CH3COOH+OH- ΔH2>0 ( K2=5.71×10-10 )
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
A.混合溶液pH>7
B.对混合溶液进行微热,K1增大、K2减小
C.调节混合溶液的pH至中性,则此时溶液中c(Na+)=c(CH3COO-)
D.温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO-)减小
【答案】C
【解析】
试题分析:A.根据题干知,醋酸电离程度大于醋酸根离子水解程度,所以常温下,等体积、等物质的量浓度的醋酸和醋酸钠溶液混合后,溶液中存在c(OH-)<c(H+),呈酸性,所以混合溶液pH<7,A错误;B.醋酸电离和醋酸根离子水解都是吸热反应,升高温度促进醋酸电离、醋酸根离子水解,所以对混合溶液进行微热,K1增大、K2增大,B错误;C.溶液呈中性,则c(OH-)=c(H+),任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)=c(CH3COO-),C正确;D.温度不变,在混合溶液中加入少量NaOH固体,OH-和H+反应促进醋酸电离,则溶液中c(CH3COO-)增大,D错误;答案选C。


科目:高中化学 来源: 题型:
【题目】室温下,在0.2 mol·L-1Al2(SO4)3,溶液中,逐滴加入1.0mol·L-1NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是

A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-![]() Al(OH)3
Al(OH)3
B.a~b段,溶液pH增大,A13+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定温度下,某容积为2 L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如右图,依图所示:
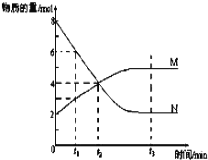
(1)该反应的化学方程式是____________________________。
(2)在图上所示的三个时刻中,_______(填t1、t2或t3)时刻达到化学反应限度。
II.一定温度下将6 mol A及6 mol B混合于2 L的密闭容器中,
发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
(1)平衡时D的浓度=___________________。
(2)B的平均反应速率υ(B)= ___________________________。
(3)x=_________。
(4)开始时容器中的压强与平衡时的压强之比为______________(化为最简整数比)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,室温时甲、乙两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下止水夹K,使两瓶内气体充分接触后,容器内压强最小的是( )
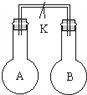
编号 | A | B | C | D |
甲中气体 | H2S | H2 | NH3 | NO |
乙中气体 | SO2 | Cl2 | HCl | O2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B两种烃组成的混合气体,混合气体的平均相对分子质量随A的物质的量分数变化关系如图所示。
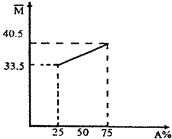
(1)A的相对分子质量是_______________。
(2)A、B化学式分别为___________、____________,A、B互为______________。
(3)A分子中碳原子_______在一条直线上(填“可能”、“一定”、“一定不”);A分子的二氯代物有______(填数目)种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )

A.500mL 2.0mol·L-1 HCl和500mL 2.0mol·L-1 NaOH的反应符合图1,且ΔE=57.3kJ
B.500mL 2.0mol·L-1 H2SO4和500mL 2.0mol·L-1 Ba(OH)2的反应符合图2,且ΔE=114.6kJ
C.发生图1能量变化的任何反应,一定不需加热即可发生
D.CaO、浓硫酸溶于水时的能量变化符合图1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com