
| A. | 氧化还原反应的实质是电子转移 | B. | 氧化剂在反应中本身被还原 | ||
| C. | 氧化反应和还原反应同时进行 | D. | 氧化还原反应一定有单质参加 |
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2O的质量为18g/mol | B. | CH4的摩尔质量为16g | ||
| C. | 3.01×1023个SO2分子的质量为32g | D. | 标准状况下,1molH2O体积是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
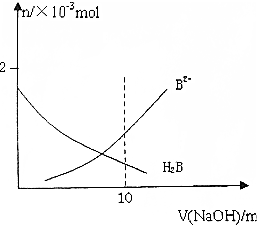 常温下,向10mL 0.2mol/L H2B溶液中滴加0.2mol/L NaOH溶液.溶液中H2B和B2-的物质的量变化如图,根据图示判断,下列说法正确的是( )
常温下,向10mL 0.2mol/L H2B溶液中滴加0.2mol/L NaOH溶液.溶液中H2B和B2-的物质的量变化如图,根据图示判断,下列说法正确的是( )| A. | 当V(NaOH)=10mL时,溶液中有关粒子浓度大小关系为:c(Na+)>c(B2-)>c(HB-)>c(H2B)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2B溶液混合后其溶液中,水的电离程度被促进 | |
| C. | 向NaHB溶液中加水稀释,溶液中c(Na+),c(B2-),c(HB-),c(OH-)均减小 | |
| D. | 当V(NaOH)=10mL时,溶液中存在下列关系c(H2B)+c(H+)=c(OH-)+c(B2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
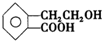 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.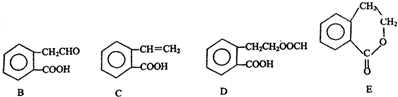
 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 +2H2O.
+2H2O. .
.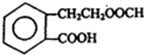 +2NaOH$\stackrel{△}{→}$HCOONa+
+2NaOH$\stackrel{△}{→}$HCOONa+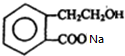 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3在水溶液中水解:HCO3-+H2O?H3O++CO32- | |
| B. | 电解饱和食盐水:C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+Cl2↑+OH- | |
| C. | 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e一=4OH- | |
| D. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去氯化钾中混有的KI:溶于水通入过量氯气,蒸发结晶 | |
| B. | 除去Na2CO3固体中混有的NaHCO3:加热至恒重 | |
| C. | 除去食盐中的泥沙:溶于水,过滤,滤液蒸发结晶 | |
| D. | 从溴水中提取溴单质:加入酒精萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有盐酸的洁厕剂和含有次氯酸钠的消毒液混用可以增强洗涤和消毒的效果 | |
| B. | 过量的Fe和Cu在等物质的量的Cl2中燃烧,转移的电子数相等 | |
| C. | 等体积、等浓度的NH4Cl溶液和稀氨水中,所含NH4+的数目相等 | |
| D. | 等物质的量的过氧化钡(BaO2)和Ba(OH)2固体中,阴阳离子个数比均为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
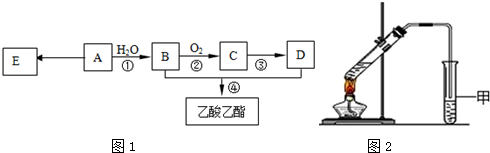
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
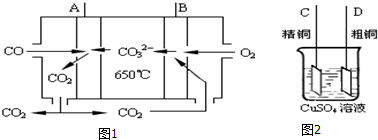
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com