

| 实验操作 | 预期现象 | 结论 |
| 假设一成立 |
分析 (1)亚硫酸根离子具有强的还原性能够还原单质碘;
(2)温度越高,氯气溶解度越小;
(3)①单质遇到淀粉变蓝色;
②若生成碘酸根离子,则发生氯气氧化碘的反应,依据得失电子守恒、原子个数守恒写出反应方程式;
(4)①反应结束时,碘反应完全,滴加最后一滴液体时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点;
根据关系式IO3-~3I2~6S2O32-进行计算;
②实验测得结果偏高,说明滴定消耗的Na2S2O3标准液体积偏高,溶液中碘的含量偏高,应是生成的碘离子被氧气氧化为碘所致.
解答 解:(1)亚硫酸根离子与碘发生氧化还原反应,离子方程式:SO32-+I2+H2O=2I-+SO42-+2H+;
故答案为:SO32-+I2+H2O=2I-+SO42-+2H+;
(2)温度越高,氯气溶解度越小,为增加氯气溶解的量,应控制在低温条件下,
故答案为:使氯气在溶液中有较大的溶解度(或防止I2升华或防止I2进一步被氧化);
(3)①碘单质遇到淀粉变蓝色,所以向所得无色溶液中加入淀粉试液,若不变蓝色,说明不存在碘;
故答案为:
| 实验操作 | 预期现象 |
| 取所得无色溶液,向其中加入淀粉试液 | 溶液不变蓝 |
点评 本题考查了氧化还原反应方程式书写、氧化还原滴定,熟悉氧化还原反应规律及物质的性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | X2YZ3 | B. | X2YZ4 | C. | X3YZ4 | D. | X4Y2Y7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1NH4A溶液显中性,说明HA为弱电解质 | |
| B. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| C. | Na、Al、Fe三种单质在一定条件下都能与水反应生成H2和相应的碱 | |
| D. | 水电离出的c(OH-)=1×10-13mol•L-1的溶液中,可能大量存在:Na+、K+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 | |
| B. | “地沟油”不能食用,但经加工处理后,可用来制造肥皂和生物柴油 | |
| C. | 糖类、油脂、蛋白质等都具有固定的熔沸点 | |
| D. | 可用热的饱和碳酸钠溶液除去金属表面的矿物油(如机油、润滑油等) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验方案 | |
| A | 检验亚硫酸钠固体是否变质 | 取少量固体于试管中,加水溶解,滴加硝酸钡溶液产生白色沉淀,滴加盐酸,观察沉淀是否溶解 |
| B | 测定镁铝混合物中铝的质量分数 | 取mg混合物,加入足量NaOH溶液,充分反应后,过滤、洗涤、烘干,剩余土体ag,计算 |
| C | 检验某无色溶液中说法存在NH4+ | 取少量无色溶液于试管中,滴加NaOH溶液、加热.用湿润的红色石蕊试纸检验生成的气体,观察试纸是否变蓝 |
| D | 除去MgCl2溶液中的少量FeCl3 | 像溶液中加入足量Mg(OH)2分末,充分搅拌、静置、过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Fe2+、Na+、SCN-、Cl- | B. | Ca2+、Cu2+、NO3-、SO32- | ||
| C. | Na+、Ba2+、Cl-、HCO3- | D. | Al3+、Na+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某有机物(结构如图)的一种同分异构体同时满足下列条件:
某有机物(结构如图)的一种同分异构体同时满足下列条件: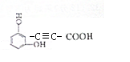 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 或
或
 .写出该两步反应所需的试剂及条件液溴、溴化铁作催化剂、溴、光照
.写出该两步反应所需的试剂及条件液溴、溴化铁作催化剂、溴、光照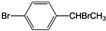 与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色.
与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com