
| A、将钠投入硫酸铜溶液中只有紫红色固体析出 |
| B、过氧化钠投入硫酸亚铁溶液中出现白色沉淀 |
| C、氨水滴入氯化铝溶液中先出现白色沉淀后溶解 |
| D、饱和氯化钙溶液加入浓氢氧化钠溶液出现白色沉淀 |


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
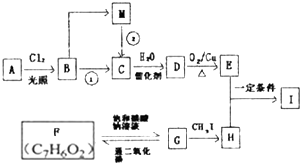
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用如图装置可验证同主族元素非金属性的变化规律
利用如图装置可验证同主族元素非金属性的变化规律| 题号 | 实 验 要 求 | 答案 |
| ① | 从碘水中提取碘单质 | |
| ② | 提纯混有少混NaCl的KNO3 | |
| ③ | 鉴别NaCl和KCl | |
| ④ | 检验自来水中残余氯分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5molAl与足量盐酸反应转移电子数为1NA |
| B、标准状况下,11.2L SO3所含的分子数为0.5NA |
| C、0.1 mol CH4所含的电子数为1 NA |
| D、46 g NO2和N2O4的混合物含有的分子数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
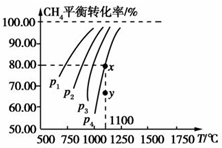 在2L的恒容密闭容器中,充入0.2molCO2和0.2molCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )
在2L的恒容密闭容器中,充入0.2molCO2和0.2molCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )| A、上述反应的△H>0 |
| B、压强:P4>P3>P2>P1 |
| C、1100℃,P1时该反应平衡常数约为16.4 |
| D、压强为p4时,在y点:V正>V逆 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com