
| A. | 它们都含有 92个中子 | B. | 235U原子核外有143个电子 | ||
| C. | 它们互为同位素 | D. | 它们是同种核素 |
分析 ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U同属于铀元素的两种不同原子,故互为同位素,由于均属于铀元素,故质子数、电子数均相同而中子数不同,从而导致质量数不同,据此分析.
解答 解:A、${\;}_{92}^{235}$U和${\;}_{92}^{238}$U同属于铀元素的两种不同原子,故其中子数一定不同,${\;}_{92}^{235}$U的中子数为143,${\;}_{92}^{238}$U的中子数为146,故A错误;
B、原子的电子数等于其质子数,故${\;}_{92}^{235}$U的核外有92个电子,故B错误;
C、${\;}_{92}^{235}$U和${\;}_{92}^{238}$U同属于铀元素的两种不同原子,故互为同位素,故C正确;
D、${\;}_{92}^{235}$U和${\;}_{92}^{238}$U同属于铀元素的两种不同原子,是两种不同的核素,故D错误.
故选C.
点评 本题考查了同位素、核素等知识点,难度不大,注意同位素的化学性质相同物理性质不同.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:解答题
| 组别 | KMnO4溶液 /ml | H2C2O4溶液 /ml | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 8.00 | 5.00 | 3.00 | 20 | |
| Ⅱ | 8.00 | 5.00 | 3.00 | 30 | |
| Ⅲ | 8.00 | 5.00 | 1.00 | 20 | 2.00 mL 蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl | B. | NaF | C. | Na2O | D. | NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若电解质溶液为KOH溶液,则电池工作一段时间后pH有明显变化 | |
| B. | Zn作负极,被氧化 | |
| C. | Ag2O在正极上发生还原反应 | |
| D. | 电解质溶液中的阴离子移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
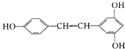
| A. | 是苯酚的同系物 | B. | 可发生加成、氧化、取代等反应 | ||
| C. | 所有原子可能共平面 | D. | 分子式为C14H12O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①②③⑤ | B. | ①②③④⑤ | C. | 仅②③④⑥ | D. | 仅①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
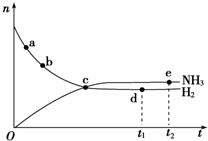 氮是重要的非金属元素,单质用途之一是制取氨气,反应方程式为:
氮是重要的非金属元素,单质用途之一是制取氨气,反应方程式为: 该反应的化学方程式为N2H4+2H2O2=N2↑+4H2O.
该反应的化学方程式为N2H4+2H2O2=N2↑+4H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
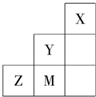
| A. | M、Z可形成ZM2分子 | B. | X原子最外层达到8电子结构 | ||
| C. | 原子半径:Z>M>Y | D. | Z2-的结构示意图可表示为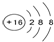 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com