
【题目】T℃时,有甲、乙两个密闭容器,甲容器的体积为1 L,乙容器的体积为2 L,分别向甲、乙两容器中加入6 mol A和3 mol B,发生反应如下:3A(g)+bB(g)![]() 3C(g)+2D(g) ΔH<0;4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L;t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L。根据题给信息回答下列问题:
3C(g)+2D(g) ΔH<0;4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L;t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L。根据题给信息回答下列问题:
(1)甲容器中反应的平均速率v(B)=____,化学方程式中计量数b=____;
(2)乙容器中反应达到平衡时所需时间t___4min(填“大于”、“小于”或“等于”),原因是_____;
(3)若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是___;
A. 保持温度不变,增大甲容器的体积至2L
B. 保持容器体积不变,使甲容器升高温度
C. 保持容器压强和温度都不变,向甲中加入一定量的A气体
D. 保持容器压强和温度都不变,向甲中加入一定量的B气体
(4)写出平衡常数表达式K=____,并计算在T℃时的化学平衡常数K=____。
【答案】0.3 molL-1min-1 1 大于 乙容器的体积大于甲容器的体积,反应物的浓度减小,反应速率减慢,达到平衡所需要的时间变长 AC  10.8
10.8
【解析】
(1)反应前,甲容器中A的浓度为6molL-1,B的浓度为1.8mol/L,4min甲容器内的反应达到化学平衡后,A的浓度减少了3.6molL-1,B的浓度减少了1.2molL-1,根据反应速率的计算公式结合化学反应方程式中各物质的化学反应速率之比等于化学计量数之比计算解答;
(2)根据容器甲和容器乙的体积大小判断反应物浓度大小,根据浓度越小,反应速率越慢判断;
(3)根据勒夏特列原理,结合等效平衡规律分析判断;
(4)根据平衡常数的表达式写出反应3A(g)+B(g)3C(g)+2D(g)的平衡常数的表达式;根据T℃甲容器中达到平衡时各组分的浓度计算出T℃时的化学平衡常数K。
(1)甲容器的体积为1L,加入6molA和3molB,则A、B的浓度分别为:6mol/L、3mol/L,4min时甲容器内的反应恰好达到平衡,A的浓度为2.4mol/L、B的浓度为1.8mol/L,则A的浓度变化为:△c(A)=6mol/L-2.4mol/L=3.6mol/L,B的浓度变化为:△c(B)=3mol/L-1.8mol/L=1.2mol/L,此时间内平均速率v(B)=![]() =0.3 molL-1min-1;浓度变化与化学计量数成正比,即3∶b=△c(A)∶△c(B)=3.6mol/L∶1.2mol/L=3∶1,即b=1,故答案为:0.3 molL-1min-1;1;
=0.3 molL-1min-1;浓度变化与化学计量数成正比,即3∶b=△c(A)∶△c(B)=3.6mol/L∶1.2mol/L=3∶1,即b=1,故答案为:0.3 molL-1min-1;1;
(2)甲容器的体积为1L,乙容器的体积为2L,乙容器的体积大于甲容器的体积,乙容器中气体的浓度小,则乙容器中反应速率小,到达平衡的时间长,所以乙容器中反应达到平衡时所需时间大于4min,故答案为:大于; 乙容器的体积大于甲容器的体积,反应物的浓度减小,反应速率减慢,达到平衡所需要的时间变长;
(3)由于该反应是体积增大的放热反应,甲的容器体积小,则压强大,平衡向着逆反应方向移动,甲中反应物的转化率小于乙,且达到平衡时甲中各组分浓度都大于乙。A.保持温度不变,增大甲容器的体积至2L,则此时甲和乙为等效平衡,甲、乙容器中B的平衡浓度相等,故A正确;B.保持容器体积不变,使甲容器升高温度,该反应为放热反应,平衡向着逆反应方向移动,甲中B的浓度增大,无法满足甲、乙容器中B的平衡浓度相等,故B错误;C.保持容器压强和温度都不变,向甲中加入一定量的A气体,反应物A的浓度增大,平衡向着正反应方向移动,甲中B的浓度减小,可能实现甲、乙容器中B的平衡浓度相等,故C正确;D.保持容器压强和温度都不变,向甲中加入一定量的B气体,达到平衡时甲中B的浓度更大,无法满足甲、乙容器中B的平衡浓度相等,故D错误;故答案为:AC;
(4)反应3A(g)+B(g)3C(g)+2D(g)的平衡常数为:K= ,T℃时甲容器中:
,T℃时甲容器中:

在T℃时的化学平衡常数K= =
=![]() =10.8,故答案为:
=10.8,故答案为: ;10.8。
;10.8。


科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五种物质中含有同一种元素,其相互转化的关系如图所示。已知
五种物质中含有同一种元素,其相互转化的关系如图所示。已知![]() 是黄色固体,回答下列问题。
是黄色固体,回答下列问题。
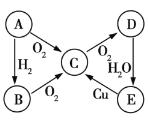
(1)写出![]() 、
、![]() 的化学式:
的化学式:![]() ______、
______、![]() ______。
______。
(2)写出![]() 的化学方程式:____________。
的化学方程式:____________。
(3)将足量的物质![]() 通入
通入![]() 溶液中,下列说法正确的是______(填序号)。
溶液中,下列说法正确的是______(填序号)。
a.溶液没有明显变化
b.溶液中出现白色沉淀
c.若继续通入![]() ,则溶液中出现白色沉淀
,则溶液中出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】㈠下列有关实验的叙述,正确的是(填序号)______________
A、用NaOH溶液除去乙酸乙酯中混有的乙酸、乙醇,然后分液
B、分馏石油时,温度计的末端必须插入液面下
C、用分液漏斗分离环己烷和水的混合液体
D、用浓氨水洗涤做过银镜反应的试管
E、配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加到沉淀刚好溶解为止
F、蔗糖水解后,直接滴加新制氢氧化铜悬浊液并加热检验水解产物中的葡萄糖
㈡某化学活动小组设计以下装置进行不同的实验。其中a为用于鼓入空气的气囊,b为螺旋状铜丝,c中盛有冰水。

(1)若用A装置做乙醇与乙酸的酯化反应实验,则还需连接的装置是____(填序号),该装置中应加入试剂__________。从实验安全角度考虑,A装置试管中除加入反应液外,还需加入的固体物质是__________。
(2)该小组同学欲做乙醇氧化成乙醛的实验,则应选用的装置是_________(填序号),再用制得的乙醛溶液进行银镜反应,正确的操作顺序是_____________。
A、②④①③ B、④②③① C、④②①③ D、④①②③
①向试管中滴入3滴乙醛溶液。②一边振荡一边滴入2%的稀氨水,直至最初产生的沉淀恰好溶解为止。③振荡后放入热水中,水浴加热。④在洁净的试管中加入1mL2%的AgNO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列的图示与对应的叙述相符的是

A. 图1表示向l00mL0.l mol·L-l的A1Cl3溶液中滴加1 mol·L-1的NaOH溶液时n [Al(OH)3]的变化情况
B. 图2表示KNO3的溶解度曲线,图中a点表示的溶液通过升温可以得到b点
C. 图3表示某一放热反应,若使用催化剂,E1、E2、△H都会发生改变
D. 图4表示向Na2CO3溶液中滴加稀盐酸时,产生n(CO2)的情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为检验某溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是![]()

A.原溶液中一定含有![]() B.原溶液中一定含有
B.原溶液中一定含有![]()
C.原溶液中一定含有![]() D.原溶液中一定含有
D.原溶液中一定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.生物质能与氢能均属于一次能源
B.电解熔融MgCl2可以得到单质Mg和氯气,该反应是一个放出能量的反应
C.相同状况下,已知:2SO2+O2![]() 2SO3 ΔH<0,则2SO3
2SO3 ΔH<0,则2SO3![]() 2SO2+O2是一个吸热反应
2SO2+O2是一个吸热反应
D.取一定量的Ba(OH)2·8H2O晶体和NH4Cl晶体于烧杯中搅拌,烧杯壁下部变冷,放出的气体使蓝色石蕊试纸变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液,加氢氧化钠溶液过程中无沉淀生成;
②另取少量原溶液,逐滴加入5mL0.2mol·L-1盐酸,产生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.287g。
下列说法中正确的是( )
A.该溶液中一定不含Ba2+、Mg2+、Al3+、SiO32-、Cl-
B.该溶液中一定含有K+、AlO2-、CO32-、Cl-
C.该溶液是否有K+需做焰色反应实验(透过蓝色钴玻璃片)
D.可能含有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是( )
A.图①表示某放热反应在无催化剂(a)和有催化剂(b)时反应的能量变化,且加入催化剂降低了反应的活化能
B.图②表示Al3+与OH-反应时溶液中含铝微粒浓度变化的曲线,a点溶液中存在大量AlO2- 
C.图③表示已达平衡的某反应在时改变某一条件后反应速率随时间变化的曲线,则改变的条件不一定是加入催化剂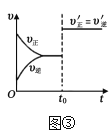
D.图④表示向某明矾溶液中加入Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积的关系,在加入20mLBa(OH)2溶液时铝离子恰好沉淀完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种元素是短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W是该元素所在周期原子半径最大的元素,W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键,该分子中含有10个电子。Z原子最外层电子数是次外层电子数的3倍,试判断:
(1)Y和W两种元素的元素符号为Y________,W________。
(2)W2Z2的电子式为________________。
(3)①由X、Y、Z所形成的常见离子化合物是__________________(写化学式)。
②该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为___________。
③化合物WY3的晶体结构中含有的化学键为________(选填序号)。
A.只含离子键 B.只含共价键 C.既含离子键又含共价键
④X与W形成的化合物与水反应时,水作________(填“氧化剂”或“还原剂”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com