
| A. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH- )=c(CH3COO-)-c(CH3COOH) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+ )>c(OH? )=c(H+) | |
| D. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl- )+c(ClO- )+c(OH? ) |
分析 A.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合得到等浓度的醋酸钠和醋酸的混合溶液,溶液中存在电荷守恒和物料守恒分析;
B.pH=8.3的NaHCO3溶液显碱性,碳酸氢根离子水解程度大于其电离程度;
C.pH=11的氨水与pH=3的盐酸等体积混合,一水合氨为弱电解质又电离出氢氧根离子,溶液显碱性;
D.溶液中一定存在电荷守恒.
解答 解:A.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合得到等浓度的醋酸钠和醋酸的混合溶液,溶液中存在电荷守恒c(H+)+c(Na+)=c(OH- )+c(CH3COO-),物料守恒2c(Na+)=c(CH3COO-)+c(CH3COOH),得到2c(H+)-2c(OH- )=c(CH3COO-)-c(CH3COOH),故A正确;
B.pH=8.3的NaHCO3溶液显碱性,碳酸氢根离子水解程度大于其电离程度,溶液中离子浓度大小c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故B错误;
C.pH=11的氨水与pH=3的盐酸等体积混合,一水合氨为弱电解质又电离出氢氧根离子,溶液显碱性:c(NH4+ )>c(Cl-)>c(OH? )>c(H+),故C错误;
D.新制氯水中加入固体NaOH溶液中存在电荷守恒c(Na+)+c(H+)=c(Cl- )+c(ClO- )+c(OH? ),故D错误;
故选A.
点评 本题考查了电解质溶液中离子浓度大小、电荷守恒、物料守恒、弱电解质电离平衡等,掌握基础是解题关键,题目难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O?Cl2↑+H2↑+2OH- | |
| B. | 向氯化铝溶液中滴加少量Na2CO3溶液:2Al3++3CO32-?Al2(CO3)3↓ | |
| C. | 一定量明矾溶液中滴加Ba(OH)2溶液至沉淀的质量最大时:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | |
| D. | FeCl3溶液与NaAlO2溶液混合:Fe3++3AlO2-?Fe(AlO2)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | pH=5的下列溶液(①NH4Cl溶液②CH3COOH溶液;③稀盐酸)中由水电离出来的c(H+)水 ①>②>③ | |
| C. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) | |
| D. | pH相同的下列三种溶液(①CH3COONa、②NaHCO3、③NaClO)中的c(Na+):①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何能使熵值增大的过程都自发进行 | |
| B. | 已知热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-Q kJ•mol-1(Q>0),则将2mol SO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量 | |
| C. | 人类利用的能源都是通过化学反应获得的 | |
| D. | 1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B、C、D离子的半径大小是D>B>C | |
| B. | C的单质能将F单质从AF的溶液中置换出来 | |
| C. | 氧化物对应的水化物的酸性:B<F | |
| D. | B与C能存在F同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
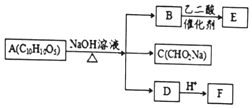 某芳香化合物A有如下转化:
某芳香化合物A有如下转化: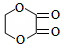 1mol F 最多消耗2mol NaOH.
1mol F 最多消耗2mol NaOH.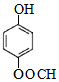
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
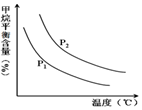 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com