
现有甲、乙、丙(如下图》三种晶体的晶胞:(甲中x处于晶胞的中心,乙中a处于
晶胞的中心),可推知:甲晶体中x与y的个数比是__________,乙中a与b的个数比是__________,丙晶胞中有_______个c离子,有____________个d离子。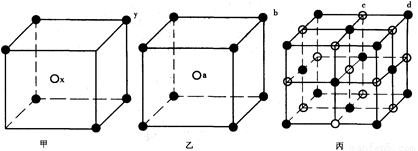
科目:高中化学 来源: 题型:
 某课外活动小组准备用如图所示的装置进行实验.现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:
某课外活动小组准备用如图所示的装置进行实验.现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:| A电极 | B电极 | X溶液 | |
| 甲 | Cu | Zn | H2SO4 |
| 乙 | Pt | Pt | CuCl2 |
| 丙 | Fe | Cu | ? |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
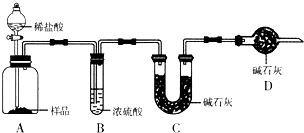 现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数(纯碱样品中Na2CO3的质量分数为92%~96%),分别设计如下实验方案,请你帮助他们完成实验.
现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数(纯碱样品中Na2CO3的质量分数为92%~96%),分别设计如下实验方案,请你帮助他们完成实验.
|
| 分析与计算 分组 |
计算样品中碳酸钠的质量分数 | 实验结果的评价 | 实验失败的主要原因及对结果的影响 |
| 甲 | ① |
失败 | ② |
| 乙 | ③ |
成功 | ----- |
| 丙 | ④ |
成功 | ---- |
查看答案和解析>>
科目:高中化学 来源: 题型:
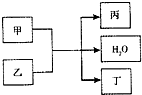 现有甲、乙、丙、丁4种物质,其中甲为单质,其余三种为化合物.转化关系如下:
现有甲、乙、丙、丁4种物质,其中甲为单质,其余三种为化合物.转化关系如下:查看答案和解析>>
科目:高中化学 来源: 题型:
物质 | 除杂方法(或试剂) | 化学方程式 |
CO(CO2) |
|
|
Na2CO3固体(NaHCO3) |
|
|
(2)某课外活动小组准备用如下图所示的装置进行实验。现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:

| A电极 | B电极 | X溶液 |
甲 | Cu | Zn | H2SO4 |
乙 | Pt | Pt | CuCl2 |
丙 | Fe | Cu | ? |
①甲同学在实验中将电键K5闭合,Zn电极上的电极反应式为___________________________。
②乙同学准备进行电解CuCl2溶液的实验,则电解时的总反应方程式为:__________________。
实验时应闭合的电键的组合是:____________________。(从下列五项中选择所有可能组合,第三小题也在这五项中选择)
A.K1和K2 B.K1和K
③丙同学准备在Fe上镀Cu,选择了某种盐来配制电镀液,则该盐中应含的阳离子的化学式为________,实验时,应闭合的电键的组合是________(选项如上)。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
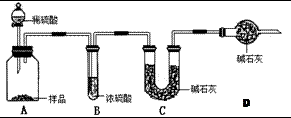 工业上制纯碱的方法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱(纯碱样品中Na2CO3的质量分数为92%~96%)。涉及到的化学方程式有:
工业上制纯碱的方法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱(纯碱样品中Na2CO3的质量分数为92%~96%)。涉及到的化学方程式有:
NH3+CO2+H2O → NH4HCO3,NH4HCO3+NaCl(饱和)→ NaHCO3↓+NH4Cl,![]() 。请回答:
。请回答:
(1)工业制得的纯碱中常常含有少量的氯化钠杂质,其主要原因是 。
(2)现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计如下方案,请你帮助他们完成如下实验。
甲:用 (填实验仪器)称取10.0g样品,利用上图所示装置,测出反应后装置C中碱石灰增重3.52g。装置D中碱石灰的作用是 。
乙:准确称取10.00g样品后,用 (填实验仪器)配成1000mL溶液,用
式滴定管量取25.00mL放入锥形瓶中,加入2滴酚酞作指示剂,用0.15mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+HCl → NaCl+NaHCO3)。完成三次平行实验后,消耗盐酸体积的平均值为15.00mL。
丙:准确称取10.00g样品后,向其中加入过量的盐酸,充分反应直至样品中无气泡冒出,蒸干混合溶液将所得到固体物质于干燥器中冷却至室温后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。请分析、计算后填表:
| 分析与计算 分组 | 计算样品中碳酸钠的质量分数 | 实验结果的评价 | 实验失败的主要原因及对结果的影响 |
| 甲 |
| 失 败 | |
| 乙 |
|
| |
| 丙 |
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com