
| 8g×106 |
| 80 |
| 8g×84 |
| 40 |
| 8 |
| 40 |


科目:高中化学 来源: 题型:
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-… | Cl2、Mn2+… |
| A、第①组反应的其余产物为H2O |
| B、第②组反应中Cl2与FeBr2的物质的量之比大于或等于1:2 |
| C、第③组反应中生成1mol Cl2,转移电子5mol |
| D、氧化性由强到弱顺序为MnO4->Cl2>Br2>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
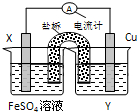 依据氧化还原反应:Fe(s)+Cu2+(aq)=Fe2+(aq)+Cu(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:Fe(s)+Cu2+(aq)=Fe2+(aq)+Cu(s)设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,2.24L CH4中含有0.4NA个共价键 |
| B、100mL 1mol?L-1 Na[Al(OH)4]溶液中含有0.1个[Al(OH)4]- |
| C、常温条件下,5.6g Fe与足量稀HNO3反应,转移0.2NA个电子 |
| D、标准状况下,1.12L 1H2和0.2g 2H2均含有0.1NA个质子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com