


科目:高中化学 来源:2013-2014学年江西省上饶市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
节能减排是当今社会的热门话题,研发混合动力汽车对于中国汽车业的未来具有重要的战略意义。混合动力汽车持续工作时间长,动力性好的优点,无污染、低噪声的好处,汽车的热效率可提高10%以上,废气排放可改善30%以上,某种混合动力汽车的动力系统由“1.6L汽油机十自动变速器十20kW十200V镍氢电池”组成。
①混合动力汽车所用的燃料之一是乙醇,lg乙醇完全燃烧生成CO2气体和液态H2O放出30.0kJ热量,写出乙醇燃烧的燃烧热的热化学方程式???????????? 。
 ②镍氢电池的使用可以减少对环境的污染,它采用储氢金属为负极,碱液NaOH为电解液,镍氢电池充电时发生反应?????????????????????????????????? 。其放电时的正极的电极反应方程式为???????? 。
②镍氢电池的使用可以减少对环境的污染,它采用储氢金属为负极,碱液NaOH为电解液,镍氢电池充电时发生反应?????????????????????????????????? 。其放电时的正极的电极反应方程式为???????? 。
③常温下,同浓度的Na2CO3溶液和NaHCO3溶液的pH都大于7,两者中哪种的pH更大,其原因是???? 。0.1mol·L-1 Na2CO3中阴离子浓度大小关系是??? ,向0.1mol·L-1 NaHCO3溶液中滴入少量氢氧化钡溶液,则发生反应的离子方程式为:????????????? 。
(2)二氧化锰、锌是制备干电池的重要原料,工业上用软锰矿(含MnO2)和闪锌矿(含ZnS)
联合生产二氧化锰、锌的工艺如下:

①操作Ⅰ需要的玻璃仪器是?????? 。
②软锰矿(含MnO2)和闪锌矿与硫酸反应的化学方程式为 ????? ,上述电解过程中,当阴极生成6.5g B时阳极生成的MnO2的质量为 ???? 。
③利用铝热反应原理,可以从软锰矿中提取锰,发生的化学方程式为?????? 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)混合动力汽车因具有能量利用率高(95%以上)、节省汽油、发动机噪音低和几乎没有尾气污染等优良性能,受到越来越多的关注,某种混合动力汽车的动力系统由“1.3L汽油机+5速手动变速器+10kW电机+144V镍氢电池”组成。
①汽油机的燃料之一是乙醇,1g乙醇完全燃烧放出29.7kJ热量,写出乙醇燃烧的热化学方程式___________________________________。
②镍氢电泄的使用可减少重金属离子污染,它采用储氢金属作为负极,碱液(主要是KOH)作为电解液,镍氢电池充电时发生反应:Ni(OH)2=== Ni(OH)+1/2H2。其放电时正极电极反应式为__________________________________。
③常温下,浓度同为0.1mol·L-l的NaHCO3溶液和Na2CO3 溶液pH 值都大于7 ,两者中_______ pH更大,其原因是:___________________________________。
(2)二氧化锰、锌是制造干电池的重要原料,工业上用软锰矿(含MnO2)和闪锌矿(含ZnS)联合生产二氧化锰、锌的工艺如下:
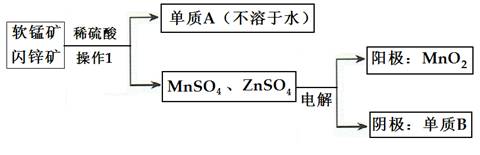
①操作1的名称为___________,单质A为____________,单质B为______________。
②上述电解过程中,当阴极生成6.5gB时阳极生成MnO2质量为_________________。
③利用铝热反应原理,可从软锰矿中提取单质锰,写出其化学反应式:__________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)混合动力汽车因具有能量利用率高(95%以上)、节省汽油、发动机噪音低和几乎没有尾气污染等优良性能,受到越来越多的关注,某种混合动力汽车的动力系统由“1.3L汽油机+5速手动变速器+10kW电机+144V镍氢电池”组成。
①汽油机的燃料之一是乙醇,1g乙醇完全燃烧放出29.7kJ热量,写出乙醇燃烧的热化学方程式___________________________________。
②镍氢电泄的使用可减少重金属离子污染,它采用储氢金属作为负极,碱液(主要是KOH)作为电解液,镍氢电池充电时发生反应:Ni(OH)2=== Ni(OH)+1/2H2。其放电时正极电极反应式为__________________________________。
③常温下,浓度同为0.1mol·L-l的NaHCO3溶液和Na2CO3 溶液pH 值都大于7 ,两者中_______ pH更大,其原因是:___________________________________。
(2)二氧化锰、锌是制造干电池的重要原料,工业上用软锰矿(含MnO2)和闪锌矿(含ZnS)联合生产二氧化锰、锌的工艺如下:
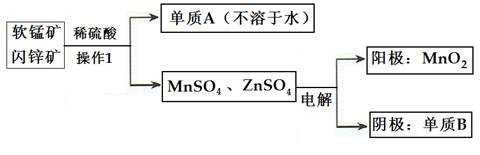
①操作1的名称为___________,单质A为____________,单质B为______________。
②上述电解过程中,当阴极生成6.5gB时阳极生成MnO2质量为_________________。
③利用铝热反应原理,可从软锰矿中提取单质锰,写出其化学反应式:__________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com