
科目:高中化学 来源:2016-2017学年安徽省宿州市高一上学期期末教学质量检测(a卷)化学试卷(解析版) 题型:选择题
只用一种试剂就可将AgNO3、KSCN和H2SO4、NaOH四种无色溶液区分,这种试剂是
A. Fe(NO3)3溶液 B. MgC12溶液 C. BaC12溶液 D. FeC13溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省六校协作体高一下学期期初化学试卷(解析版) 题型:选择题
在硫酸铝、硫酸钾和明矾[KAl(SO4)2·12H2O]的混合溶液中,SO42—的浓度为0.3mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
A. 0.225mol/L B. 0.25mol/L C. 0.35mol/L D. 0.7mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:简答题
短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B原子的价电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为_______________。
(2)已知:①E-E→2E·;△H=+a kJ·mol-1
② 2A·→A-A;△H=-b kJ·mol-1
③E·+A·→A-E;△H=-c kJ·mol-1(“·”表示形成共价键所提供的电子)
写出298K时,A2与E2反应的热化学方程式____________________________________。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2 molA2、1 molBC | 1 molX | 4 molA2、2 molBC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 | α1 | α2 | α3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则该时间段内A2的平均反应速率v(A2)________。
②该温度下此反应的平衡常数K的值为___________。
③三个容器中的反应分别达平衡时各组数据关系正确的是_______(填序号)。
A.α1+α2=1 B.Q1+Q2=d C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为65.5%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。_______

查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
如下图所示,下列说法正确的是( )
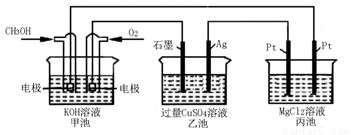
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
已知:
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )

A. CO的标准燃烧热为283 kJ
B. 下图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-532 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源:河北省2016-2017学年高一下学期开学考试化学试卷 题型:选择题
下列实验操作中错误的是
A. 蒸馏操作时,冷凝管中冷却水应低进高出
B. 萃取操作时,必须选择密度比水大的萃取剂
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 蒸发操作时,不能等到蒸发皿中水分完全蒸干后才停止加热
查看答案和解析>>
科目:高中化学 来源:河北省2016-2017学年高一下学期开学考试化学试卷 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述错误的是
A. 含14g硅原子的二氧化硅晶体中含有的硅氧键数目为2NA
B. 3.9g Na2O2晶体中含有0.2NA个离子
C. 常温常压下,5g D2O含有的质子数、电子数、中子数均为2.5NA
D. 3mol H2和1mol N2在一定条件下反应所得混合气体分子数大于2NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省广州市高一上学期期期末考试化学试卷(解析版) 题型:实验题
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
【查阅资料】1、无水FeCl3在空气中易潮解,加热易升华。
2、氯气(Cl2)是一种有毒的黄绿色气体,能与NaOH溶液反应。
【实验探究】学习小组设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
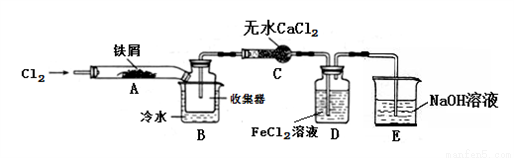
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为:______________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是:____________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填操作步骤序号)____________。
(4)装置D中FeCl2溶液全部反应后,因失去吸收Cl2的作用而失效,写出证明FeCl2溶液已经失效的操作方法:________________。
(5)该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到黄色固体。请写出该反应的离子方程式:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com