
回答以下关于第三周期元素及其化合物的问题。
(1)下列能用于判断氧和氟非金属性强弱的是 (选填编号)。
A.气态氢化物的稳定性 B.最高价氧化物对应水化物的酸性
C.单质与氢气反应的难易 D.单质与同浓度酸发生反应的快慢
(2)Be和Al具有相似的化学性质,写出BeCl2水解反应的化学方程式
(3)常温下,不能与铝单质发生反应的是_________(填序号)
A.CuSO4溶液 B.Fe2O3 C.浓硫酸 D.NaOH E.Na2CO3固体
(4)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1266 | 1534 | 183 |
 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。(1)AC
(2)BeCl2+2H2O  Be(OH)2+2HCl
Be(OH)2+2HCl
(3)B、E
(4)NaF与 MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高。(2分)
正四面体(1分),相等(1分)
(5) (1分) 0.0625mol/L? min (1分)
(1分) 0.0625mol/L? min (1分)
解析试题分析:(1)判断氧和氟非金属性强弱可依据气态氢化物的稳定性,由于氟没有最高价氧化物对应水化物,故不能通过酸性比较,还可通过单质与氢气反应的难易判断,非金属单质一般不会与酸发生反应,故不可。选AC。
(2)BeCl2是一种强酸弱碱盐,其水解反应的化学方程式BeCl2+2H2O  Be(OH)2+2HCl 。
Be(OH)2+2HCl 。
(3)A.铝单质与CuSO4溶液发生置换反应。B.Fe2O3 不能发生。 C.浓硫酸发生钝化。 D.NaOH与铝生成偏铝酸钠和氢气。 E.Na2CO3固体与铝不发生反应。故常温下,不能与发生反应的是B、E。
(4)NaF与 MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高。SiF4发生SP3杂货,分子的空间构型为正四面体,SiF4中Si—F键间的键角相等。
(5)反应4HCl+O2  2Cl2+2H2O,的平衡常数的表达式
2Cl2+2H2O,的平衡常数的表达式 ;则HCl的平均反应速率为(2.5mol-2.25mol)/(2L*8min)= 0.0625mol/L? min。
;则HCl的平均反应速率为(2.5mol-2.25mol)/(2L*8min)= 0.0625mol/L? min。
考点:本题考查元素非金属性强弱判断,晶体熔沸点判断,化学反应速率的计算等。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:填空题
X、Y、Z、M、N、Q为元素周期表前四周期的六种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X元素在周期表中的位置是 ,属于 区元素,它的外围电子的电子排布图为 。
(2)XZ2分子的立体结构是 ,YZ2分子中Y的杂化轨道类型为 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 。
(3)含有元素N的盐的焰色反应为 色,许多金属盐都可以发生焰色反应,其原因是 。
(4)元素M与元素Q形成晶体结构如图所示,设其晶胞边长为a pm,则a位置与b位置之间的距离为_______pm(只要求列算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同。回答下列问题:
(1)X、Y和Z的元素符号分别为______、______、______。
(2)由上述元素组成的化合物中,既含有共价键又含有离子键的有________、________。
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是________。
此化合物在酸性条件下与高锰酸钾反应的离子方程式为__________________________。
此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA3型分子。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。据此回答下列问题:
(1)D元素在元素周期表中的位置是 。
(2)B与D所形成的化合物电子式为 。
(3)将C单质的水溶液滴加到B与D所形成化合物的水溶液中,产生淡黄色沉淀,其反应的化学方程式为 。
(4)实验室里除去BA2气体,可用下列试剂中的 (填字母)。
A.酸性高锰酸钾溶液 B.浓硫酸
C.NaOH溶液 D.品红溶液
(5)由A、B、D三种元素所组成的某种盐水溶液显碱性,其原因是 (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(本题共12分)
我国钾长石(KAlSi3O8)的资源比较丰富。工业上可用食盐和钾长石在一定条件下制备氯化钾:NaCl (l) +KAlSi3O8 (s)  KCl (l)+NaAlSi3O8 (s)。
KCl (l)+NaAlSi3O8 (s)。
完成下列填空:
(1)硅原子的最外层电子占据了 个轨道,有 种能量。
(2)氯化钠的熔点比氯化钾的 (填“高”或“低”),原因是 。
(3)把反应中涉及到的六种元素的原子半径按从小到大的顺序排列 。
(4)参与上述反应且位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应,这种元素是 。
(5)为研究上述反应中钾元素的熔出率(液体中钾元素的质量占全部钾元素质量的百分率)与温度的关系,进行实验(氯化钠与钾长石投料的质量比为2:1),获得如下数据:
| 时间(h) 钾元素 温度 熔出率 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 890℃ | 0.579 | 0.691 | 0.694 | 0.699 | 0.699 |
| 950℃ | 0.669 | 0.714 | 0.714 | 0.714 | 0.714 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是常见的非金属元素,主要以钠盐的形式存在于海水中。
(1)Y在元素周期表中的位置是________;X氢化物的电子式为_________。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈_______(填“酸”、“碱”或“中”)性,用离子方程式表示其原因是________。
(3)Y-Ag2O电池是应用广泛的鱼雷电池,其原理如下图所示。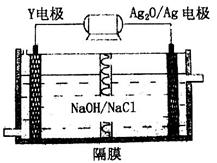
该电池的负极反应式是________。
(4)Z和W比较,非金属性较弱的是________(填元素符号),下列可以验证这一结论的是_________
(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1mol H—Z或H—W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。
| | Q | R | |
| T | | | W |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。用化学用语回答下列问题。
| a | | | |||||||||||||||
| | | | | | | | | | | | | b | c | d | | | |
| e | | f | g | | h | i | | ||||||||||
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有X、Y、Z、W四种元素,它们的单质X、Y、Z在常温常压下皆为气体,W为固体。
①X单质可在Z单质中燃烧生成XZ,其火焰为苍白色;W单质在Y单质中剧烈燃烧产生黄色火焰,生成W2Y2;
②每2molX2可与1molY2化合生成2molX2Y,X2Y在常温下为液体;
③化合物XZ的水溶液可使蓝色石蕊试纸变红;W与水反应后的溶液可使无色酚酞试液变红色;
④Z单质溶于化合物X2Y,所得溶液具有漂白作用;请回答:
(1)画出Z原子的原子结构示意图 ;实验室中的W应保存在____________中(填试剂名称)
(2)写出化学式W2Y2___________ _K#S5U
(3)写出与W+具有相同核外电子数的分子或原子,请写出任意3种的化学式
① ② ③
(4)Z单质与水反应的离子方程式:_________________________
⑸W单质与X2Y化学反应方程式:__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com