
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。其部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
回答下列问题:
Ⅰ.实验室合成硫酰氯要先制取干燥氯气。制备干燥纯净的氯气所用仪器如下图:

(1)圆底烧瓶中发生的离子反应方程式为_____________。
(2)上述仪器的连接顺序是:e接 , 接 , 接 , 接 (按气流方向,用小写字母表示)。______________________
II.催化合成硫酰氯的实验装置如下图 (夹持仪器已省略):
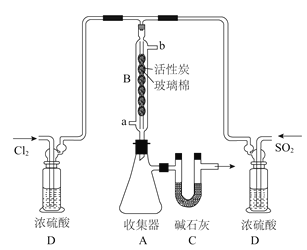
(3)仪器B冷却水的进口为________(填“a””或“b”),活性炭的作用是________。
(4)装置D除干燥气体外,另一作用是_______________。若缺少D,则硫酰氯会水解,该反应的化学方程式为________________。
(5)某同学建议将收集器A放在冰水中冷却,你认为该同学的建议是否合理,为什么? _______
【答案】 MnO2+4H++2Cl-![]() Mn2++Cl2↑+H2O e接d,c接a,b接i,h接g a 催化剂 通过观察气泡控制气流速度(或比例) SO2Cl2+2H2O===H2SO4+2HCl 合理,防止硫酰氯分解
Mn2++Cl2↑+H2O e接d,c接a,b接i,h接g a 催化剂 通过观察气泡控制气流速度(或比例) SO2Cl2+2H2O===H2SO4+2HCl 合理,防止硫酰氯分解
【解析】本题考查实验方案设计与评价,(1)此装置制备氯气,其离子反应方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+H2O;(2)制备干燥的氯气,烧瓶中制备的氯气含有HCl和水蒸气,一般用饱和食盐水除去HCl,因此e接d,用浓硫酸除去水蒸气,因此c接a,然后进行收集,因此氯气的密度大于空气,因此用向上排空气法收集,即b接i,氯气是有毒气体,必须进行尾气处理,因此h接g;(3)冷凝管冷却水的通入一般是从下向上通入,即从a口通入冷却水,本实验的目的是催化合成硫酰氯,因此活性炭的目的作催化剂;(4)因为硫酰氯易水解,因此装置D作用是干燥气体,同时为了原料充分利用,需要控制气流速度或比例,即装置D的另一个作用是观察气泡控制气流的速率或比例;根据信息,硫酰氯水解产生大量白雾,此白雾是HCl,反应方程式为SO2Cl2+2H2O=H2SO4+2HCl;(5)根据信息,硫酰氯易分解,因此收集A应放在冷水中冷却,目的是防止硫酰氯分解。
Mn2++Cl2↑+H2O;(2)制备干燥的氯气,烧瓶中制备的氯气含有HCl和水蒸气,一般用饱和食盐水除去HCl,因此e接d,用浓硫酸除去水蒸气,因此c接a,然后进行收集,因此氯气的密度大于空气,因此用向上排空气法收集,即b接i,氯气是有毒气体,必须进行尾气处理,因此h接g;(3)冷凝管冷却水的通入一般是从下向上通入,即从a口通入冷却水,本实验的目的是催化合成硫酰氯,因此活性炭的目的作催化剂;(4)因为硫酰氯易水解,因此装置D作用是干燥气体,同时为了原料充分利用,需要控制气流速度或比例,即装置D的另一个作用是观察气泡控制气流的速率或比例;根据信息,硫酰氯水解产生大量白雾,此白雾是HCl,反应方程式为SO2Cl2+2H2O=H2SO4+2HCl;(5)根据信息,硫酰氯易分解,因此收集A应放在冷水中冷却,目的是防止硫酰氯分解。


科目:高中化学 来源: 题型:
【题目】下列有关实验的说法错误的是( )
A.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
B.无色溶液中加Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,不能说明原溶液中一定有SO42﹣
C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的 ![]() ,液体也不能蒸干
,液体也不能蒸干
D.将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个体重50kg的健康人体内含铁元素2g,这2g铁元素以Fe2+和Fe3+的形式存在.Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4).服用维生素C可使食物中的Fe3+转化成Fe2+ , 有利于人体对铁的吸收.请回答下列问题:
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是 .
A.Fe
B.Fe2+
C.Fe3+
(2)维生素C可使食物中的Fe3+转化为Fe2+ , 在此过程中是氧化剂,说明维生素C具有性.
(3)在人体中进行Fe2+ ![]() Fe3+的转化时,
Fe3+的转化时,
①反应中的Fe2+发生反应,②反应中的Fe3+被 .
(4)市场上出售的某种麦片中含有微量的颗粒细小的还原性铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐.此反应的化学方程式为 , 离子方程式为 .
(5)己知下列反应:
①H2O2+2Fe3+=2Fe2++O2↑+2H+②2Fe2++H2O2+2H+=2Fe3++2H2O
反应①中生成1molO2转移电子的物质的量为 , 反应①、②的总反应方程式为 ,
在该反应中Fe3+的作用为 .
(6)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了性和性,毎有1molFe参加反应转移电子mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. SO2具有还原性,故可作漂白剂
B. Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg
C. 浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
D. Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中的Fe也显+3价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个图像的有关描述错误的是 ( )
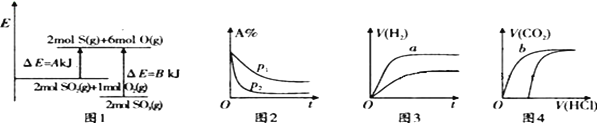
注:ΔE:表示能量,p表示压强;t表示时间,V表示体积,%表示体积百分含量。
A. 图1表示反应2S02(g)+O2(g) ![]() 2S03(g)的能量变化,该反应的ΔH=(A-B)kJ/mol
2S03(g)的能量变化,该反应的ΔH=(A-B)kJ/mol
B. 图2表示其他条件不变时,反应2A(g)+B(g) ![]() C(g)+D(g)在不同压强下随时间的变化
C(g)+D(g)在不同压强下随时间的变化
C. 图3表示体积和浓度均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液
D. 图4表示100 mL 0.1mol· L-1 Na2CO3和NaHCO3两种溶液中,分别逐滴滴加0.1mol· L-1 HCl,产生CO2 的体积随盐酸体积的变化,则b表示NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图所示。下列分析正确的是
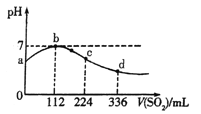
A. a点对应溶液的导电性比d点强
B. 氢硫酸的酸性比亚硫酸的酸性强
C. 向d点对应的溶液中加入Ba(NO3)2溶液,产生BaSO4白色沉淀
D. H2S饱和溶液的物质的量浓度为0.05 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Fe3O4是一种非常重要的磁性材料,同时也可用作催化剂载体和微波吸收材料。納米级Fe3O4有多种不同制法,请回答下列相关问题。
I.下图是用共沉淀法制备纳米四氧化三铁的流程。

(1)除Fe3O4外铁的两种常见氧化物中在空气中性质比较稳定的是_______(填化学式),该物质的用途是___________(任写一种)。
(2)实验室保存溶液B 时为了防止出现浑浊通常采用的措施是___________ 。
(3)证明沉淀已经洗涤干净的操作是___________ 。
(4)写出该方法中发生的主要反应的离子方程式___________ 。
(5)实际生产中为提高产率,起始所用FeSO4·7H2O 和FeCl3·6H2O 的物质的量之比大于1:2,原因是___________。
II.制备纳米四氧化三铁的另一种流程如下图所示。
![]()
(6)写出第2 步反应的化学方程式______________,其中氧化产物和还原产物的物质的量之比为______。
(7)纳米Fe3O4投入分散剂中形成的分散系是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com