
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
分析 (1)加入的物质用于调节pH以除去杂质,主要将铁离子转化为氢氧化铁沉淀,且不能引入新杂质,先根据溶液的pH计算氢离子浓度,再结合水的离子积常数计算氢氧根离子浓度,最后根据c(Fe3+)=$\frac{Ksp(Fe(OH)_{3})}{{c}^{3}(O{H}^{-})}$计算c(Fe3+);
(2)加热时促进氯化铜的水解且生成的氯化氢易挥发造成水解完全,要想得到较纯的无水氯化铜应在氯化氢气流中抑制其水解;
(3)依据碘化钾和氯化铜发生氧化还原反应,生成碘化亚铜沉淀,和碘单质,
①碘单质遇淀粉变蓝,依据碘单质被Na2S2O3标准溶液滴定到终点,溶液变化为无色;
②根据物质间的关系式进行计算;
③若滴定终点时俯视滴定管刻度,读取标准溶液体积减小;
④若加入KI后,部分I-因被空气中的氧气氧化,生成碘单质增大,消耗标准溶液体积增大.
解答 解:(1)为得到纯净的CuCl2•2H2O晶体要除去氯化铁,则溶液中的Fe3+转化为Fe(OH)3沉淀,加入物质能与酸反应能转化为氯化铜,且不能引进杂质,可以是Cu(OH)2、CuO、CuCO3或Cu2(OH)2CO3;
溶液的pH=4,所以溶液中氢氧根离子浓度为10-4 mol/L,则氢氧根离子浓度为10-10 mol/L,c(Fe3+)=$\frac{Ksp(Fe(OH)_{3})}{{c}^{3}(O{H}^{-})}$=$\frac{2.6×1{0}^{-39}}{(1×1{0}^{-3})^{3}}$=2.6×10-9mol/L,
故答案为:Cu(OH)2、CuO、CuCO3或Cu2(OH)2CO3;2.6×10-9mol/L;
(2)由于CuCl2在加热过程中水解被促进,且生成的HCl又易挥发而脱离体系,造成水解完全,得到碱式氯化铜,以至于得不到CuCl2,反应方程式为:CuCl2•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(OH)Cl+HCl↑+H2O,要想得到较纯的无水氯化铜应在氯化氢气流中抑制其水解,并带走水蒸气,
故答案为:CuCl2•2H2O在加热时会发生水解(可能混有CuCl2、Cu(OH)2、Cu(OH)Cl、CuO等杂质);在干燥的HCl气流中加热脱水;
(3)测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL;反应的化学方程式为:2Na2S2O3+I2═Na2S4O6+2NaI,
①硫代硫酸钠滴定碘单质,利用碘单质遇淀粉变蓝选择指示剂为淀粉;终点时溶液蓝色褪去,且半分钟内不变色,
故答案为:淀粉;蓝色变为无色,且在半分钟内无变化;
②依据2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I-═2CuI↓+I2;
得到 2Na2S2O3 ~2Cu2+
2 2
0.1000mol/L×0.0200L 0.002mol
则CuCl2•2H2O的物质的量为:0.002mol,
试样中CuCl2•2H2O的质量百分数为$\frac{0.002mol/L×171g/mol}{0.36g}$×100%=95.0%,
故答案为:95.0%;
③若滴定终点时俯视滴定管刻度,读取标准溶液体积减小,则由此测得的CuCl2•2H2O的质量分数会偏小,
故答案为:偏小;
④若加入KI后,部分I-因被空气中的氧气氧化,生成碘单质增大,消耗标准溶液体积增大,测定结果偏大,
故答案为:偏大.
点评 本题考查Ksp计算和物质制备,利用平衡移动原理、氧化还原滴定分析解答,明确滴定过程的反应原理和计算方法是解本题的关键,注意加热灼烧CuCl2溶液和CuSO4溶液得到固体的区别,为易错点,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
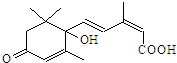
| A. | 该物质的分子式为C15H20O4 | |
| B. | 能发生消去反应 | |
| C. | 既能与FeCl3溶液发生显色反应,又能使溴水褪色 | |
| D. | 1mol该物质与NaOH溶液反应,最多可消耗1mol NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、硫酸、五水硫酸铜 | B. | NH3、Cu、空气 | ||
| C. | NaOH、SO2、空气 | D. | 氨水、食盐、酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO用于高炉炼铁 | |
| B. | 用稀盐酸除去热水瓶胆壁上的水垢(主要成分是CaCO3) | |
| C. | 用盐酸除铁锈(铁锈主要成分是Fe2O3) | |
| D. | 用小苏打(NaHCO3)治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
装置 |  | 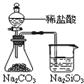 |  | 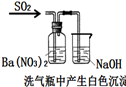 |
| 结论 | A.Ag2O/Ag极发生 还原反应 | B.能证明非金属性Cl>C>Si | C.验证铁发生析氢腐蚀 | D.白色沉淀是BaSO3 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
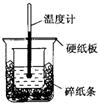 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是( )
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是( )| A. | 从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题 | |
| B. | 大烧杯上如不盖硬纸板,测得的中和热数值会偏大 | |
| C. | 用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会偏大 | |
| D. | 实验中改用60 mL 0.50 mol•L-1盐酸跟50 mL 0.55 mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量不相等,但是所求中和热相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀HCl | B. | 饱和NaOH溶液 | C. | FeCl3溶液 | D. | CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,35Cl、37Cl之间的关系是同位素.
,35Cl、37Cl之间的关系是同位素.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com