
��27.2 g Cu��Cu2O�Ļ�����м���ijŨ�ȵ�ϡ����0.5 L������������ȫ��Ӧ������NO��Cu(NO3)2����������Һ�м���1.0 mol/L��NaOH��Һ1.0 L����ʱ��Һ�����ԣ�������������ȫ��������������Ϊ39.2 g�������й�˵������ȷ����
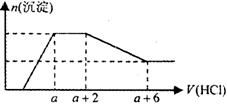 A��Cu��Cu2O�����ʵ���֮��Ϊ2��1
A��Cu��Cu2O�����ʵ���֮��Ϊ2��1
B����������ʵ���Ũ��Ϊ2.6 mol/L
C��������NO�ڱ�״���µ����Ϊ4.48 L
D��Cu��Cu2O�����ᷴӦ��ʣ��HNO3Ϊ0.2 mol

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�о�NO2��SO2���ȴ�����Ⱦ����Ĵ���������Ҫ���壮
��1��NO2����ˮ���գ���Ӧ�Ļ�ѧ��Ӧ����ʽΪ��3NO2+H2O=NO+2HNO3�������÷�Ӧ6NO2+8NH3 7N2+12H2OҲ�ɴ���NO2����ת��1.2mol����ʱ�����ĵ�NO2�ڱ�״�����ǡ�6.72��L��
7N2+12H2OҲ�ɴ���NO2����ת��1.2mol����ʱ�����ĵ�NO2�ڱ�״�����ǡ�6.72��L��
��2����֪��2SO2��g��+O2��g��⇌2SO3��g����H=��196.6kJ•mol��1
2NO��g��+O2��g��⇌2NO2��g����H=��113.0kJ•mol��1
��ӦNO2��g��+SO2��g��⇌SO3��g��+NO��g���ġ�H=����41.8��kJ•mol��1��
һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���ǡ�b����
a����ϵѹǿ���ֲ��� b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ��� d��ÿ����1mol SO3��ͬʱ����1molNO2
���������Ӧƽ��ʱNO2��SO2�����Ϊ1��6����ƽ�ⳣ��K=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ���Ը�������Ҫ�ɷ�ΪFeO��Cr2O3����̼���ơ�������������Ϊԭ�������ظ����ƣ�Na2Cr2O7��2H2O��������Ҫ��ӦΪ��
��1��4FeO��Cr2O3 + 8Na2CO3 + 7O2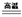 8Na2CrO4 + 2Fe2O3 + 8CO2
8Na2CrO4 + 2Fe2O3 + 8CO2
��2��2Na2CrO4 + H2SO4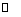 Na2SO4 + Na2Cr2O7 + H2O
Na2SO4 + Na2Cr2O7 + H2O
����˵����ȷ���ǣ�������
A����Ӧ��1���ͣ�2����Ϊ������ԭ��Ӧ
B����Ӧ��1������������O2����ԭ����FeO��Cr2O3
C�������£�O2��������ǿ��Fe2O3������Na2CrO4
D����Ӧ��1����ÿ����1molNa2CrO4ʱ����ת��3mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijԪ��X�˵����С��18����ԭ�ӵĵ��Ӳ���Ϊn������������Ϊ2n+1��ԭ�Ӻ�����������2n2��1�������й�X��˵���У�����ȷ����
A��X���γɻ�ѧʽΪX��OH��3�ļ�
B��X���γɻ�ѧʽΪNaXO3�ĺ���������
C��Xԭ�ӵ������������ͺ˵����������Ϊż��
D��X����ijЩ����Ԫ�ػ�ǽ���Ԫ���γɻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��B��C��D��ԭ������������������ֶ�����Ԫ�أ��ס��ҡ������������������е����ֻ�����Ԫ����ɵĻ����������CԪ���γɵĵ��ʡ���֪����+�ң���+����
��+������+����������0.1 mol/L ����Һ��pHΪ13������˵����ȷ����
A��Ԫ��B�����ڱ��е�λ��Ϊ�ڶ����ڵ�VIA��
B��Ԫ��B��C��D��ԭ�Ӱ뾶�ɴ�С��˳��Ϊr (D)��r(C)��r(B)
C��1.0 L��0. 1 mol/L����Һ���������ܵ����ʵ���С��0. 1 mol
D��1 mol��������������ȫ��Ӧ��ת����Լ6.02��1023������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
2�Ķ�����A��B��C��D��E��F���ֶ�����Ԫ�ص������Ϣ��
�ٺ�A��������ɫ��ӦΪ��ɫ�� ��B��ԭ�����������������ڲ��������3������C�����������Neԭ�ӵĵ�������ͬ�����ھ�����ͬ�������ļ����������Ӱ뾶��С����D��B����ͬ���塣 ��Ŀǰ������֪������(�����˹����������)�У������������EԪ�ء� ��FԪ�ص�ij��ԭ����ֻ�����ӣ�û�����ӡ������������Ϣ�ش����⣺
(1)����֪����Ԫ���е�������ɵ�������ˮ�������У��ܴٽ�ˮ�����������________(д��һ�����ʵĻ�ѧʽ����ͬ)��������ˮ�����������________��
(2)��ˮ��Դ��Ҫ���ں��Ϻ���Ƽ������Ƶĺ����õ���ʩ����Դ���ú�ˮ�����Һ�������е��������������C�ĵ�����Ϊ������д�����ֺ�ˮ��Դ��������Ӧʽ��
(3)�����£������Ϊ1.5 L��Ũ��Ϊ0.1 mol��L��1��A������������Ӧˮ�����ˮ��Һ��ͨ��2.24 L(��״��)EB2���壬����Ӧ��ֺ���Һ�и�����Ũ���ɴ�С��˳����_______
(4)�����£���c(H��)��1 mol/L��c(Al3��)��c(Fe3��)��0.04 mol��L��1����Һ�м���A������������Ӧˮ�������Һ���Ե�����Һ��pH(������Һ�������)����ô���������ij�����____ __(д��ѧʽ)���ո���������ʱ��Һ��pH��______��(��֪Ksp[Al(OH)3]��1.3��10��33 mol4��L��4��Ksp[Fe(OH)3]��2.6��10��39 mol4��L��4)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������ȷ���� ( )
A��ֱ������1��10 nm֮������ӳ�Ϊ����
B��Fe(OH)3�����Ǵ�����
C�����ö����ЧӦ����������Һ�뽺��
D���������Ӳ���������ֽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����������ʹ�õĽ���֮һ�����������仯�����֪ʶ������������⡣
��1��������Ԫ�ؼ������������л�ԭ�Ե������� ________������ĸ�������
A. Fe B��FeCl3 C��FeSO4 D��Fe2O3
��2�����ˮ����εμ�1 mol/L FeCl3��Һ����Һ������ĺ��ɫ���÷�ɢϵ������ֱ���ķ�Χ�� ________nm��
��3�����ӹ�ҵ��Ҫ��30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ������ӡˢ��·�壬��д��FeCl3��Һ��ͭ��Ӧ�����ӷ���ʽ��___________________________
______________________________��ijУͬѧΪ�ⶨFeCl3��ʴͭ��������Һ����ɣ�����������ʵ�飺
����ȡ����������Һ������KSCN��Һ�ʺ�ɫ������Һ�к��еĽ�����������_________________________,�ڴ˻����ϣ��ֽ����˶�����ɵIJⶨ��ȡ50.0mL������Һ�������м���������AgNO3��Һ���ð�ɫ���������ˡ������������������Ϊ43.05 g.��Һ��c(Cl��)���� �� mol/L.
��4����Ҫ��֤����Һ�к���Fe2+����ȷ��ʵ�鷽���� ��
A.���Թ��м�����Һ������KSCN��Һ������Ѫ��ɫ��֤������Fe2+��
B.���Թ��м�����Һ���������Ը��������Һ������ɫ��֤������Fe2+��
C.���Թ��м�����Һ��������ˮ���ٵ���KSCN��Һ������Ѫ��ɫ��֤��ԭ��Һ�к���Fe2+
��5�����ӷ�ˮ�л���ͭ�������»��FeCl3��Һ���ʵ�鷽�����£�

A��д������ʵ���м�������ɵ��й����ʵĻ�ѧʽ��
�� _____________��____________��______________��________________
B��д��ͨ��Ļ�ѧ����ʽ__________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��ӦX+Y= M+NΪ���ȷ�Ӧ���������Ӧ������˵������ȷ���ǣ� ��
A��X������һ������M�ģ�Y������һ������N��
B����Ϊ�÷�ӦΪ���ȷ�Ӧ����һ��Ҫ���ȷ�Ӧ���ܽ���
C���ƻ���Ӧ���еĻ�ѧ�������յ�����С���γ��������л�ѧ�����ų�������
D��X��Y��������һ������M��N��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com