
【题目】在100℃时,将0.40mol的二氧化氮气体充入2L真空的密闭容器中,发生反应: 2NO2(g)![]() N2O4(g) △H=-24.4kJ/mol,每隔一段时间对该容器内的物质进行分析,得到数据如表所示:
N2O4(g) △H=-24.4kJ/mol,每隔一段时间对该容器内的物质进行分析,得到数据如表所示:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4 )/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)从反应开始至20s时,二氧化氮的平均反应速率为_______mol·L-1·s-1。
(2)n3=______,100℃时该反应的平衡常数为______(保留一位小数)。平衡后,若升高温度,该反应的化学平衡常数将_______(填“增大”、“减小”或“不变”)。
(3)下述各项能说明反应达到平衡状态的是_______(填序号)。
a.v正(N204)= 2v逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
(4)达到平衡后,分别在80s、120s、140s时只改变一个条件,v正、v逆发生如下图所示变化;则80s时改变的条件可能是________。

(5)若在相同情况下,最初向该容器中充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是_______mol/L。
【答案】 0.002 5 0.24 2.8 减小 bc 向该容器中充入四氧化二氮 0.10
【解析】(1)从反应开始直至20s时,生成的四氧化二氮的物质的量为0.05mol,根据反应:2NO2![]() N2O4,消耗的二氧化氮物质的量为:0.1mol,二氧化氮的反应速率为:v(NO2)=
N2O4,消耗的二氧化氮物质的量为:0.1mol,二氧化氮的反应速率为:v(NO2)=![]()
=0.0025mol·L-1·s-1;(2)60s后达到平衡,
2NO2(g)![]() N2O4(g)
N2O4(g)
n始/mol 0.4
n变/mol 0.16 0.08
n平/mol 0.24 0.08
根据表中的数据可知,60s时反应达到了平衡状态,60s和80s时二氧化氮的物质的量相等,即n3=n4,达到平衡状态时,n(N2O4)=0.08mol,n(NO2)=0.4mol-0.08mol×2=0.24mol,100℃时该反应的平衡常数为k=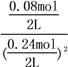 =2.8;2NO2(g)
=2.8;2NO2(g)![]() N2O4(g)△H=-24.4kJ/mol,该反应是放热反应,平衡后,若升高温度,平衡逆向移动,该反应的化学平衡常数将减小;(3)a、应是2v正(N204)=v逆(NO2) 时反应达到平衡状态,故a错误;b、体系颜色不变,说明二氧化氮浓度不变,反应到达平衡状态,故b正确;c、混合气体总质量不变,随反应减小混合气体总物质的量增大,平均相对分子质量减小,当气体平均相对分子质量不变时,反应到达平衡状态,故c正确;d、混合气体的总质量不变,容器的容积不变,气体密度始终不变,故d错误;故选bc。(4)达到平衡后,140s时v正、v逆均减小,可能是降温,降温时平衡正向移动,图中逆向移动,不符;或减小压强,平衡向气体体积增大的方向移动,符合;120s时是加入催化剂,则80s时改变的条件可能是增大生成物的浓度,平衡逆向移动,即向该容器中充入四氧化二氮。(5)若在相同情况下,最初向该容器中充入的是四氧化二氮气体,要达到上述同样的平衡状态,说明两个反应为等效平衡,根据反应方程式,需要四氧化二氮的物质的量为:0.40mol×1/2=0.20mol,c(N2O4)=0.20mol/2L=0.10mol·L-1,四氧化二氮的起始浓度是0.10mol/L。
N2O4(g)△H=-24.4kJ/mol,该反应是放热反应,平衡后,若升高温度,平衡逆向移动,该反应的化学平衡常数将减小;(3)a、应是2v正(N204)=v逆(NO2) 时反应达到平衡状态,故a错误;b、体系颜色不变,说明二氧化氮浓度不变,反应到达平衡状态,故b正确;c、混合气体总质量不变,随反应减小混合气体总物质的量增大,平均相对分子质量减小,当气体平均相对分子质量不变时,反应到达平衡状态,故c正确;d、混合气体的总质量不变,容器的容积不变,气体密度始终不变,故d错误;故选bc。(4)达到平衡后,140s时v正、v逆均减小,可能是降温,降温时平衡正向移动,图中逆向移动,不符;或减小压强,平衡向气体体积增大的方向移动,符合;120s时是加入催化剂,则80s时改变的条件可能是增大生成物的浓度,平衡逆向移动,即向该容器中充入四氧化二氮。(5)若在相同情况下,最初向该容器中充入的是四氧化二氮气体,要达到上述同样的平衡状态,说明两个反应为等效平衡,根据反应方程式,需要四氧化二氮的物质的量为:0.40mol×1/2=0.20mol,c(N2O4)=0.20mol/2L=0.10mol·L-1,四氧化二氮的起始浓度是0.10mol/L。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A. 少量SO2通入NaOH溶液中:OH-+SO2=HSO3-
B. H2S通入氯水中:S2-+Cl2 =S↓+2Cl-
C. 二氧化氮溶于水:3NO2+H2O =2H++2NO3-+NO↑
D. 少量NaHSO4与过量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列叙述正确的是( )
A.硫磺皂中的硫单质具有杀菌的功效
B.食品袋中放置的CaO可防止食品氧化变质
C.草木灰与硝酸铵混合施用效果更好
D.用碳酸钡、碳酸镁和氢氧化铝等作抗酸药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧塑料回收和利用是减轻“白色污染”、实现资源再利用的有效途径之一.某兴趣小组进行如下探究:
【实验课题】废旧聚丙烯塑料热分解主要产物的探究
【查阅资料】①石蜡热分解的产物为常温下的气态烃和液态烃
②CuO能将烃氧化成CO2和H2O
③苯甲酸能溶于苯
【实验设计】

【实验记录】
①B装置试管中有液态物质生成;②C中溴水的颜色变浅;③E装置中黑色氧化铜变红;④F装置中无水硫酸铜变蓝.
【问题讨论】请你参与实验设计的评价和实验结果的分析:
(1)经分析得知B装置试管中的液态产物是甲苯和苯的混合物.若要除去其中的甲苯,实验操作方法是________________________________________________________________;
(2)C装置的作用_____________________________________;
(3)如果不设置D装置,对实验结论产生的影响是_____________________________________;
(4)甲同学认为从C中出来的气体是氢气,乙同学认为还可能有其它成分.你认为其他成分可能是___________________;为完善实验设计,请在图2方框内画出装置图并注明其中盛放的试剂名称。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铂电极电解某金属的硫酸盐(XSO4)溶液,当阳极上收集到1.12L气体(标准状况,忽略气(体溶解)时,阴极质量增加6.4g,下列判断不正确的是
A. 该金属是Cu
B. 电路中有0.1mol电子通过
C. 电解后溶液的pH降低
D. 向电解后的溶液中加入0.1molCuO可使溶液恢复电解前的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.金属镁可用来制造信号弹和焰火
B.某些含铝的化合物可作净水剂
C.硫酸铁可用于治疗缺铁性贫血
D.二氧化硅可用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质是生产生活中的重要物质。下列有关说法不正确的是( )
A.淀粉在人体内水解的最终产物为葡萄糖
B.油脂属于酯类,可用于制取肥皂
C.蛋白质的基本结构单元是氨基酸
D.糖类、油脂、蛋白质中均只含有碳、氢、氧三种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明某溶液中只含有Fe2+而不含有Fe3+的实验操作是
A. 先滴加氯水,再滴加KSCN溶液后显红色
B. 先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C. 滴加NaOH溶液,产生红褐色沉淀
D. 滴加KSCN溶液,溶液呈红色,再加足量铁粉红色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中均需要的仪器是
①配制一定物质的量浓度的溶液 ②浓硫酸的稀释 ③过滤 ④蒸发 ⑤灼烧
A. 玻璃棒 B. 胶头滴管 C. 试管 D. 漏斗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com