
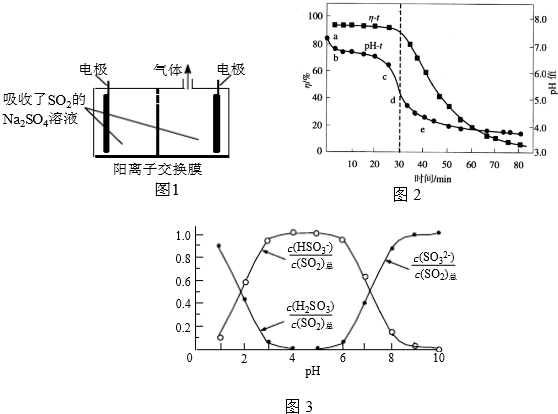
分析 (1)已知CO还原SO2生成S(g)和CO2过程中,每转移1mol电子需吸收2.0kJ的热量,则转移2mol电子需要吸收能量8KJ,依据热化学方程式书写方法,标注物质聚集状态和对应反应的焓变写出;
(2)阴极是二氧化硫在酸性溶液中得到电子生成单质硫,阳极发生氧化反应,溶液中氢氧根离子失去电子生成氧气;
(3)①根据△G=△H-T•△S判断,反应能自发进行,必须满足△H-T•△S<0;
②A.向ZnSO3与稀硫酸反应生成硫酸锌二元化气体和水;
B.ab段溶液的pH大于7,ZnO的悬浮液pH约为6.8,配制的ZnO悬浊液含少量MgO、CaO,在ab段应该为氧化钙与二氧化硫的反应;
C.cd段溶液的pH介于4~6之间,结合图3可知,该pH条件下溶液中主要存在亚硫酸氢根离子,则pH-t曲线cd段发生反应为亚硫酸锌与二氧化硫反应生成亚硫酸氢锌;
D.根据图3可知,当溶液的pH=7时,溶液的亚硫酸氢根离子稍大于亚硫酸根离子;
③根据图2中SO2的吸收效率η与时间、溶液的pH的关系对各选项进行判断.
解答 解:(1)CO还原SO2生成S(g)和CO2过程中,每转移1mol电子需吸收2.0kJ的热量,则转移4mol电子需要吸收能量8KJ,依据热化学方程式书写方法得到热化学方程式为:2CO(g)+SO2(g)═S(g)+2CO2(g)△H=+8.0 kJ•mol-1,
故答案为:2CO(g)+SO2(g)═S(g)+2CO2(g)△H=+8.0 kJ•mol-1;
(2)阴极是二氧化硫在酸性溶液中得到电子生成单质硫,电极反应为:SO2+4H++4e-═S+2H2O;阳极氢氧根离子失去电子生成O2,
故答案为:SO2+4H++4e-═S+2H2O;O2;
(3)①反应能够自发进行,必须满足:△G=△H-T•△S<0,由于反应ZnO+SO2=ZnSO3(s)的△S<0,则-T•△S>0,该反应在常温下能够进行,则必须满足:△H<0,
答案为:△H<0;
②A.向ZnSO3与水混合体系中加稀硫酸,二者反应生成硫酸锌二元化气体和水,故A正确;
B.ab段溶液的pH大于7,ZnO的悬浮液pH约为6.8,配制的ZnO悬浊液含少量MgO、CaO,在ab段应该为氧化钙与二氧化硫的反应,即::ZnO+SO2=ZnSO3,故B错误;
C.cd段溶液的pH介于4~6之间,结合图3可知,该pH条件下溶液中主要存在亚硫酸氢根离子,则pH-t曲线cd段发生的主要反应为:ZnSO3+SO2+H2O=Zn (HSO3)2,故C正确;
D.根据图3可知,当溶液的pH=7时,溶液的亚硫酸氢根离子稍大于亚硫酸根离子,即:c(SO32-)<c(HSO3-),故D错误;
故答案为:AC;
③A.增大悬浊液中ZnO的量,可以充分吸收二氧化硫,从而提高吸收效率,故A正确;
B.适当提高单位时间内烟气的循环次数,可以使二氧化硫充分吸收,从而提高了二氧化硫的吸收效率,故B正确;
C.根据图2中吸收效率与溶液的Ph关系看,溶液的pH越低,吸收效率越低,所以溶液的pH在6.0以下时吸收效率降低,故C错误;
故答案为:AB.
点评 本题考查了二氧化硫的污染与治理、化学平衡的调控作用等知识,题目难度较大,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意掌握二氧化硫的治理原理,明确化学平衡的调控方法.


科目:高中化学 来源: 题型:选择题
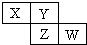 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | X的非金属性比Y的强 | |
| B. | Y的原子半径比Z的原子半径大 | |
| C. | Z的最高价氧化物的水化物为强酸 | |
| D. | W的单质可与Y的氢化物生成两种强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol | B. | 0.4mol | C. | 1.1mol | D. | 1.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为负极,锌发生氧化反应 | |
| B. | 铜为正极 | |
| C. | 负极发生还原反应,正极发生氧化反应 | |
| D. | 外电路电子流入的一极为正极,电子流出的一极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的结构简式为: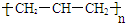 | B. | 苯分子的比例模型: | ||
| C. | 四氯化碳分子的电子式为: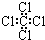 | D. | 乙烯的结构简式:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
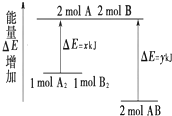
| A. | 该反应是吸热反应 | |
| B. | 断裂1molA-A键和1mol B-B 键放出xkJ能量 | |
| C. | 断裂2molA-B键需要吸收(y-x)kJ的能量 | |
| D. | 1molA2和1molB2的总能量高于2molAB的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
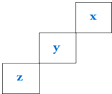
| A. | 元素Z一定是长周期元素,且既有金属性又有非金属性 | |
| B. | 三种元素中X元素的最高价氧化物对应的水化物酸性最强 | |
| C. | 三种元素中X元素的气态氢化物还原性最弱 | |
| D. | Y元素可形成多种不同的单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com