
【题目】I.分别取一定质量的甲烷、乙炔、苯、己烯、甲苯,完全燃烧后都生成m mol CO2和n mol H2O。(1)若m=n,该烃是____(2)若m=2n,该烃是____(3)若4m=7n,该烃是____
II.蒽(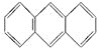 )与苯炔(|
)与苯炔(|![]() )反应生成化合物X(立体对称图形),如下图所示:
)反应生成化合物X(立体对称图形),如下图所示:
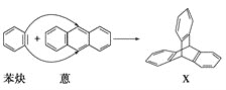
(1)蒽与X都属于(填字母)__________a.环烃 b.烃 c.不饱和烃
(2)苯炔不具有的性质是(填字母)_______
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
(3)下列属于苯的同系物的是(填字母,下同)____

(4)下列物质中,能发生加成反应,也能发生取代反应,同时能使溴水因加成反应而褪色,还能使酸性高锰酸钾溶液褪色的是____

【答案】己烯 乙炔或苯 甲苯 ab ad D D
【解析】
I. 根据有机物完全燃烧后生成的CO2与H2O的物质的量之比为m:n,根据元素守恒可知,该有机物组成中C、H原子数目为m:2n,据此判断;
II. (1)均含苯环及环状结构;
(2)含碳碳双键,可发生加成、加聚和氧化反应;
(3)苯的同系物中含1个苯环,侧链为饱和烃基;
(4)能发生加成、氧化、取代,由选项可知,含苯环和碳碳双键。
I. (1)当m=n时,则有机物组成中C、H原子数目为1:2,该烃为己烯(C6H12);
故答案为:己烯;
(2)当m=2n时,则有机物组成中C、H原子数目为1:1,该烃为乙炔(C2H2)、苯(C6H6);
故答案为:乙炔或苯;
(3)当4m=7n时,则有机物组成中C、H原子数目为7:8,该烃是甲苯(C7H8);
故答案为:甲苯;
II.(1)均含苯环及环状结构,则蒽与X都属于环烃、烃,
故答案为:ab;
(2)含碳碳三键,能发生加成、氧化反应,但不溶于水,常温下为液体,
故答案为:ad;
(3)苯的同系物中含1个苯环,侧链为饱和烃基,只有D符合,
故答案为:D;
(4)由选项D的结构中含苯环和碳碳双键,故能发生加成反应,也能发生取代反应,同时能使溴水因加成反应而褪色,还能使酸性高锰酸钾溶液褪色,选项D符合,
故答案为:D。


科目:高中化学 来源: 题型:
【题目】(1)化合物BrFx与水按物质的量之比3 :5发生反应,其产物为溴酸(HBrO3)、氢氟酸、单质溴和氧气。
①BrFx中,x=__________。
②该反应的化学方程式为__________________________________________。
③此反应的氧化剂是______________,还原剂是______________。
(2)配平下列反应式,并用双线桥标出电子转移的方向和数目
____KMnO4 +____H2O2+____H2SO4 ─____K2SO4+____MnSO4+___ O2↑ + ____H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸镁和硫酸铝的混合溶液中,c(Mg2+ )=2 mol·L-1,c(SO42-)=6.5 mol·L-1,若将200 mL此混合液中的Mg2+和Al3+分离,至少应加入1.6 mol·L-1氢氧化钠溶液的体积是
A.0.5 L B.1.625 LC.1.8 LD.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验室使用的浓盐酸的溶质的质量分数通常为36.5%,密度为1.25g/mL。
(1)该盐酸的物质的量浓度为__________mol/L。
(2)现有一种0.2mol/L的稀盐酸的含义是_________(选填字母)。
A.1L水中含有0.2mol HCl
B.1L溶液中含有0.1mol H+
C.将7.1gHCl溶于1L水所配成的溶液
D.从100mL该溶液中取出10mL,剩余溶液的物质的量浓度仍为0.2mol/L
(3)用上述实验室的浓盐酸来配制500mL1 mol/L的稀盐酸,请在下列操作步骤中填写有关的空格:
①用量筒量取________mL的浓盐酸;(精确到小数点后一位)
②向盛有少量蒸馏水的烧杯中,沿_________慢慢注入浓盐酸;
③将已冷却至室温的盐酸溶液沿玻璃棒注入________mL的容量瓶中;
④用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑤继续向容量瓶中加蒸馏水,直至液面接近刻度线1~2cm处;
⑥改用___________________逐滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
⑦盖好容量瓶塞,反复颠倒,摇匀;
⑧将配好的稀硫酸倒入试剂瓶中,贴好标签。
(4)由于操作不当,会引起实验误差。下列情况对所配制的盐酸溶液的物质的量浓度有何影响?(用“偏高”、“偏低”、“无影响”填空)
①容量瓶用蒸馏水洗涤后残留有少量的水_____________;
②定容时,某同学观察液面的情况如图所示_____________;
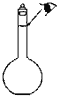
③摇匀后,发现溶液的液面低于刻度线,又加水至刻度线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)147gH2SO4的物质的量是_______;
(2)氧化铜在高温下发生分解反应:4CuO![]() 2Cu2O +O2↑,若反应过程中生成1molO2分子,则转移电子数为________mol。
2Cu2O +O2↑,若反应过程中生成1molO2分子,则转移电子数为________mol。
(3)反应:2FeCl3+2KI=2FeCl2+2KCl+I2,其中_____元素化合价升高,则该元素被_____,_____元素化合价降低;______作还原剂,_____发生还原反应。
(4)钠在空气中燃烧的化学方程式:_____,1mol钠完全燃烧转移电子的个数为______(阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用16mol/L 浓硫酸配制100mL 2.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④转移、洗涤 ⑤定容 ⑥摇匀。回答下列问题:
(1)该实验所需的玻璃仪器:______、玻璃棒、烧杯、胶头滴管、量筒。
(2)所需浓硫酸的体积是_____,量取浓硫酸所用的量筒的规格是____(规格从下列中选用A.10mL B.20mL C.50mL D.100mL)。
(3)第⑤步定容的具体实验操作是_______。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A.容量瓶用蒸馏水洗涤后残留有少量的水____。
B.转移溶液前未冷却至室温_____。
C.定容时仰视溶液的凹液面______。
D. 向容量瓶中转移溶液时,不慎有少量溶液洒在容量瓶外面____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4LCl2通入足量的NaOH溶液充分反应,有NA个电子转移
B. 100 mL 1 mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. lmolSO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
D. 84gNaHCO3固体含有CO32-离子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是门捷列夫提出元素周期表150周年,联合国将2019年定为“国际化学元素周期表年”。已知短周期元素W、X、Y、Z在周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。下列说法正确的是( )

A. W的氢化物与Z的氢化物反应,产物的水溶液呈碱性
B. 在元素周期表中,117号元素与Z元素位于同一主族
C. 氧化物对应水化物的酸性:Z>Y
D. W、X、Y、Z四种元素对应的单质的沸点:W<X<Y<Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com