
(16分)铜与浓硫酸反应,实验装置如图所示。
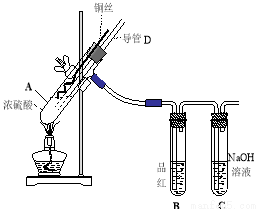
(1) 装置A中发生反应的化学方程式为: ,反应过程中试管B中的现象是 ,试管C的作用是 。
(2) 导管D的下端(虚线段)应位于 (液面上、液面下),导管D的作用有:①实验结束后排除装置中的SO2;② 。
实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有CuO、Cu2O、CuS、Cu2S。为探究甲的成分,进行了以下的实验。
查阅资料可知:Cu2O + 2HCl =CuCl2 + Cu + H2O, 2Cu2O + O2煅烧 4CuO,2CuS+3O2煅烧2CuO+2SO2 ,Cu2S+2O2煅烧2CuO+SO2 。CuS、 Cu2S和稀HCl不反应。
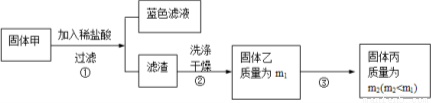
(3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。
(4) 煅烧过程中,除上述反应外,还可能发生反应的方程式为 。
(5)结论:甲中有CuO,还肯定含有的物质是 。
33.(16分)(1)Cu +2H2SO4(浓) △CuSO4+SO2↑+2H2O (2分)、品红溶液褪色(2分)、吸收多余的SO2,防止污染空气(2分)
(2)液面下;防倒吸 (4分)
(3)泥三角、坩埚(坩埚钳)(2分,坩埚钳不写不扣分)
(4)2Cu+O2 △2CuO (2分)
(5)CuS(2分)
【解析】
试题分析: (1) 该实验研究的是铜与浓硫酸的反应,因此在A装置中发生的反应方程式为Cu +2H2SO4(浓) △CuSO4+SO2↑+2H2O。反应中有SO2生成,因此B中的品红溶液被漂白褪色,C试管起到吸收过量SO2的目的,防止SO2污染空气。
(2) 由于A装置是制备SO2的发生装置,所以导管D的下端必须插入溶液中,才能防止产生的SO2不会从导管D中逸出来;而导管D的作用是在实验结束后用于排除A装置的SO2,同时能够平衡A和B中气压,防止B中液体倒吸。具体操作就是把D下端从溶液中提起。
(3) 煅烧的实验用具必须使用耐高温的坩埚,而与坩埚配套使用的还有泥三角、坩埚钳等。
(4)根据题中的判断,该固体甲可能是CuO、Cu2O、CuS、Cu2S,因此用稀盐酸溶解,根据已知的反应,反应得到的固体乙可能是Cu、CuS、Cu2S,对固体乙进行煅烧,因此除了已知的几个煅烧反应外,还可能发生的反应为单质铜的煅烧2Cu+O2 △2CuO。
(5) 根据(4)的分析,利用反应的方程式对各种成分煅烧结果进行推断分析,若Cu煅烧,煅烧生成CuO使质量增重;若CuS煅烧,煅烧产生CuO使质量减小;若Cu2S煅烧,煅烧生成CuO是质量不变。因此要满足流程中煅烧前后质量减小,则固体中必须还含有能使煅烧前后质量减小的CuS。
考点:本题考查的是


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014广东省越秀区高一下学期学业水平测试调研化学试卷(解析版) 题型:选择题
Se是人体必需微量元素,下列有关 Se和
Se和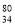 Se的说法正确的是( )
Se的说法正确的是( )
A.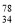 Se 和
Se 和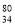 Se所含电子数不同
Se所含电子数不同
B.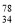 Se和
Se和 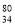 Se是两种不同的核素
Se是两种不同的核素
C.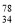 Se和
Se和 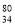 Se 分别含有44和46个质子
Se 分别含有44和46个质子
D.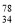 Se和
Se和 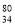 Se都含有34个中子
Se都含有34个中子
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省珠海市高三学业质量监测二模理综化学试卷(解析版) 题型:选择题
下列与有机物的结构、性质有关的叙述正确的是
A.苯、油脂均不能使酸性KMnO4溶液褪色
B. 聚酯纤维、有机玻璃、光导纤维都属于有机高分子材料
C.乙醇可以被氧化为乙酸,二者都能发生取代反应
D.淀粉和蛋白质均可作为生产葡萄糖的原料
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高一下学期期末考试化学试卷(解析版) 题型:选择题
影响化学反应速率与平衡的因素有多方面,如浓度压强温度催化剂等。下列有关说法不正确的是
A.其它条件不变时,改变压强能改变气体反应的速率,但不一定改变平衡
B.增大浓度能加快化学反应速率,原因是增大浓度就增加了反应体系中活化分子的百分数
C.温度升高使化学反应速率加快的主要原因是增加了反应体系中活化分子的百分数
D.加入催化剂能降低反应所需的活化能,使反应速率加快,平衡常数增大
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高一下学期期末考试化学试卷(解析版) 题型:选择题
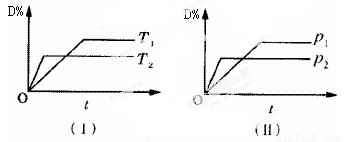
对于可逆反应mA(g)+nB(s) pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强p的关系如图所示,请判断下列说法正确的是
pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强p的关系如图所示,请判断下列说法正确的是
A.降温,化学平衡向正反应方向移动
B.使用催化剂可使D%有所增加
C.化学方程式中气体的化学计量数m>p+q
D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动
?
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省湛江市高三年级第二次模拟理综化学试卷(解析版) 题型:选择题
几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | M | R | Q | |
原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | —— |
最低负价 | —— | -1 | —— | —— | -3 | -2 | |
下列说法正确的是( )
A.元素X和Q形成的化合物中不可能含有共价键
B.X、Z、R的最高价氧化物的水化物之间可两两相互反应
C.R3-比Q2-更容易失去电子
D.M(OH)2的碱性比XOH的碱性强
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省第一学期期终考试高一级化学科试卷甲卷(解析版) 题型:填空题
A气体极易溶于水,其相对分子质量为a,在0℃、1.01×105Pa时,测得其饱和溶液的物质的量浓度为b mol/L,该溶液的密度为c g/cm3,求:
(1)A饱和溶液中溶质的质量分数;
答:c%=
(2)0℃、1.01×105帕时,1体积水中可溶解多少体积的A气体?
答:V=
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省第一学期期终考试高一级化学科试卷甲卷(解析版) 题型:选择题
除去氯气中混有的少量的氯化氢气体,最好选用
A.水 B.饱和食盐水
C.纯碱溶液 D.饱和烧碱溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高考预测理综化学试卷二(解析版) 题型:填空题
(本题16分)钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如下:
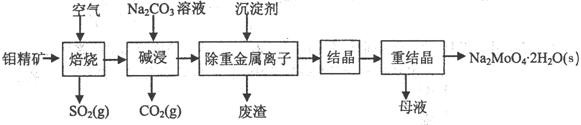 (1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
(1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
②____________________________
(2)写出焙烧时生成MoO3的化学方程式为:______________________________________
(3)写出“碱浸”反应的离子方程式:
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是 。
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果:

①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是 ________________。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4—Fe2O3保护膜。
密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是 _________________________________________。
③若缓释剂钼酸钠—月桂酸肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为
(6)锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2  Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。
Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com