
| A. | KOH | B. | CO2 | C. | CaCl2 | D. | O2 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:填空题
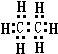 ,分子式为CmH20的烷烃中m为9,与CO2密度(同温同压)相同的烷烃分子式为C3H8,若上述三种烃各为1mol,在足量O2中燃烧,消耗O2最多的是C9H20.
,分子式为CmH20的烷烃中m为9,与CO2密度(同温同压)相同的烷烃分子式为C3H8,若上述三种烃各为1mol,在足量O2中燃烧,消耗O2最多的是C9H20.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.153 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、 -3 | +7、 -1 | +5、 -3 | -2 |
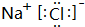 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 次氯酸和臭氧都是强氧化剂,都能杀死水中的细菌.自来水常用氯气来杀菌消毒,是因为氯气杀菌消毒效果要比臭氧好,且不会残留有毒、有害物质 | |
| B. | 人们应用原电池原理,制成了多种电池,如干电池、充电电池、高能电池等.电池在现代生产和科学技术中发挥了重要作用,但废旧电池会对生态环境和公众健康造成危害,所以废旧电池必须回收再利用 | |
| C. | 明矾常用作净水剂,但人体摄入大量铝盐,易患老年性痴呆,所以明矾不宜大量作净水剂使用 | |
| D. | 氟氯烃为一类含有氟和氯的有机物,是制冷效果极佳的制冷剂,但它会破坏臭氧层,科研人员正在积极研发环保型的替代产品以减少氟氯烃的使用量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 化学性质 |
| H2C2O4 | 189.5℃ | 二元弱酸,有毒,具有腐蚀性,易溶于水,100℃开始升华,157℃时开始分解,与浓硫酸混合加热会产生CO2、CO和H2O,草酸钙和草酸氢钙均为白色不溶物 |
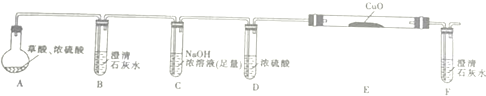
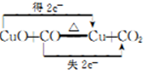
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| Ⅰ | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅱ | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅲ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
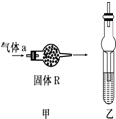 干燥管在不同情况下常具有多种功能.下列两种不同图示就分别代表了干燥管的不同应用.请回答有关问题:
干燥管在不同情况下常具有多种功能.下列两种不同图示就分别代表了干燥管的不同应用.请回答有关问题:| A | B | C | D | |
| 气体a | NH3 | SO2 | C2H4 | Cl2 |
| 固体R | 碱石灰 | 浓硫酸 | 高锰酸钾 | 碱石灰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com