
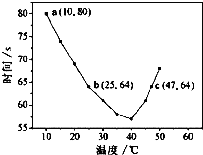
 NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol?L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol?L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )| A、40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B、温度高于40℃时,淀粉不宜用作该实验的指示剂 |
| C、图中a点对应的NaHSO3平均反应速率为2.5×10-4mol?L-1?s-1 |
| D、图中b、c两点对应的NaHSO3反应速率:b<c |
| 0.02mol/L×0.01L |
| 0.05L |
| 0.02mol/L×0.01L |
| 0.05L |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
| A、任何化学反应都伴随有能量变化 |
| B、△H>0表示放热反应,△H<0表示吸热反应 |
| C、化学键的断裂会放出能量 |
| D、反应物总能量比生成物总能量高的反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| B、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| C、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| D、验证烧碱溶液中是否含有Cl-,先加稍过量的稀硝酸除去OH-,再加入AgNO3溶液,如有白色沉淀,则证明有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和 c.实验①和 |
| ② | ||||
| ③ | ||||
| ④ |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| ① | 14.0 | 13.0 | 11.0 |
| ② | 6.0 | 7.0 | 7.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 部分结构知识 | 部分性质 |
| X | X原子核外电子占有9个原子轨道 | X的一种氧化物是形成酸雨的主要物质 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数等于2n-3 (n为原子核外电子层数) | 化学反应中Z原子易失去最外层电子形成Zn+ |
| W | W基态原子的外围电子排布式为3d64s2 | 高温下,W与水蒸气反应生成氢气和黑色氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加少量水,更多的氢氧化镁溶解 |
| B、加少量NaOH(s),氢氧化镁的溶解量减少 |
| C、加少量氯化氢,溶液的pH变大 |
| D、加少量MgCl2(s),溶液的pH变小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com