
| A. | 用A表示的反应速率是0.4mol•L-1•min-1 | |
| B. | 用B表示的反应速率是0.3mol•L-1•min-1 | |
| C. | 2min末时的反应速率,用B表示为0.3mol•L-1•min-1 | |
| D. | 在这2min内用B表示的反应速率的值是减小的,C表示的反应速率逐渐增大 |
分析 A.化学反应速率表示单位时间内浓度的变化量,固体或纯液体的浓度一般视为常数,一般也不用固体或纯液体来表示反应速;
B.根据v=$\frac{△c}{△t}$计算v(B);
C.化学反应速率为一段时间内平均速率,不是即时速率;
D.随反应进行反应物的浓度降低,B的反应速率减慢,生成物的浓度变化量逐渐减少,用C表示的速率也降低.
解答 解:A.物质A是固体,浓度不变,不能用A表示该反应的反应速率,故A错误;
B.△c(B)=$\frac{0.6mol/L}{2min}$═0.3mol/(L?min),故B正确;
C.2min末的反应速率为即时速率,用B表示速率0.3mol/(L?min)是2min内的平均速率,故C错误;
D.随反应进行反应物的浓度降低,反应速率减慢,生成物的浓度变化量逐渐减少,故2min内用B和C表示的反应速率都是逐渐减小,故D错误;
故选B.
点评 本题考查对化学反应速率的理解及有关计算,难度不大,注意化学反应速率为一段时间内平均速率,不是即时速率,A选项为易错点,学生容易忽略A为固体.


科目:高中化学 来源: 题型:选择题
| A. | 室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 | |
| D. | 已知I-3?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| B. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| C. | 在石油分馏的实验中,需要在蒸馏烧瓶中加入碎瓷片 | |
| D. | 温度计摔坏导致水银散落到地面上,应立即用水冲洗水银 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的摩尔质量是18 g | |
| B. | 0.012 kg 12C中约含有6.02×1023个碳原子 | |
| C. | 1 mol水中约含有6.02×1023个氢原子 | |
| D. | 1 mol任何物质都含有6.02×1023个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol H2完全燃烧生成液态水时放出571.6kJ的热 | |
| B. | 1 mol H2完全燃烧生成液态水时放出285.8kJ的热 | |
| C. | 2 个H2分子完全燃烧生成液态水时放出571.6kJ的热 | |
| D. | 上述热化学方程式可以表示为:H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液和AgNO3溶液混合 | B. | Na在Cl2中燃烧 | ||
| C. | CO和Fe2O3在高温下反应 | D. | Zn和稀H2SO4反应制H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
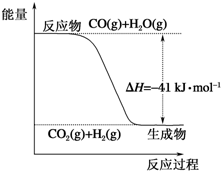 (1)根据图示写出热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1.
(1)根据图示写出热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物稳定性最强的是HZ | |
| B. | 室温下,可用Y的容器盛装稀硝酸 | |
| C. | 原子半径由小到大的顺序为:rW<rM<rY | |
| D. | X的单质可通过电解XZ的水溶液获得 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com