
K3[Fe(C2O4)3]·3H2O [三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用废铁屑等物质为原料制备,并测定产品的纯度。相关反应的化学方程式为:Fe + H2SO4 =FeSO4 + H2↑ FeSO4+H2C2O4+2H2O=FeC2O4·2H2O↓+H2SO4
2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
回答下列问题:
(1)使用废铁屑前,往往将其在1.0mol.L-1Na2CO3溶液中浸泡数分钟,其目的是 。然后使用 (填写操作名称)分离并洗涤铁屑。
(2)析出的K3[Fe(C2O4)3]·3H2O晶体可通过如下图所示装置通过减压过滤与母液分离。下列关于减压过滤的操作正确的是 。
| A.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸 |
| B.放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤 |
| C.洗涤晶体时,先关闭水龙头,用蒸馏水缓慢淋洗,再打开水龙头抽滤 |
| D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸 |
(1)除去铁屑表面的油污(1分) 倾析法(1分)
(2)AD(2分) (3)1.185(2分) 250mL容量瓶、胶头滴管(2分) 偏大(1分)
(4)①2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2↑ + 8H2O (2分)
②加入最后一滴KMnO4标准溶液后,溶液呈浅红色,且30s内不变化(1分) ③24.55 (2分)
解析试题分析:(1)碳酸钠是强碱弱酸盐,溶液显碱性,所以使用废铁屑前,往往将其在1.0mol.L-1Na2CO3溶液中浸泡数分钟的目的是除去铁屑表面的油污;由于铁是金属,不溶于水,所以可以使用倾析法分离并洗涤铁屑。
(2)A.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸,滤纸大时,滤纸边缘与漏斗产生缝隙,使过滤速度慢,沉淀抽不干,滤纸小时,滤纸不能盖住所有孔,不能过滤,故A正确;B.放入滤纸后,用玻璃棒引流来转移溶液和沉淀,再打开水龙头抽滤,故B错误;C.洗涤晶体时,先关闭水龙头,用蒸馏水缓慢淋洗,再微接水龙头,将洗涤液慢慢透过全部晶体,故C错误;D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸,故D正确,答案选AD。
(3)由于没有240ml容量瓶,所以应该配制250ml高锰酸钾溶液,则需要高锰酸钾的质量是0.03000 mol·L-1×0.25L×158g/mol=1.185g;配制该标准溶液时,所需仪器除电子天平、药匙、烧杯、玻璃棒外,还缺少的玻璃仪器有250mL容量瓶、胶头滴管;配制过程中,俯视刻度线定容则导致容量瓶中溶液的体积偏少,因此所配溶液浓度偏大。
(4)①反应中碳元素的化合价从+3价升高到+4价失去1个电子,而Mn元素的化合价从+7价降低到+2价得到5个电子,因此根据电子得失守恒可知氧化剂与还原剂的物质的量之比是2:5,则根据原子守恒可知,配平后的方程式为5C2O42-+2MnO4-+16H+=10CO2+2Mn2++8H2O。
②由于酸性高锰酸钾溶液显紫红色,所以判断到达滴定终点的现象是加入最后一滴KMnO4标准溶液后,溶液呈浅红色,且30s内不变化。
③根据方程式可知,参加反应的草酸根的物质的量是0.03000 mol·L-1×0.01L×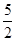 =0.0007500mol,所以2.000g样品中K3[Fe(C2O4)3]·3H2O的质量是0.0007500mol×
=0.0007500mol,所以2.000g样品中K3[Fe(C2O4)3]·3H2O的质量是0.0007500mol×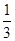 ×491/mol×
×491/mol×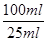 =0.491g,所以纯度为
=0.491g,所以纯度为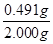 ×100%=24.55%。
×100%=24.55%。
考点:考查物质制备实验方案设计、减压过滤、物质的量浓度的配制、氧化还原滴定的有关判断与计算


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:实验题
如图所示,分馏装置中,如果有错误请指出并加以改正:
(1) _____________________________,
(2) _____________________________,
(3) _____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下: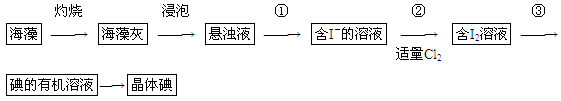 (1)实验操作③的名称是________,所用主要仪器名称为________。
(1)实验操作③的名称是________,所用主要仪器名称为________。
(2)提取碘的过程中,可供选择的有机试剂是________(填序号)。
A.酒精(沸点78℃) B.四氯化碳(沸点77℃)
C.甘油(沸点290℃) D.苯(沸点80℃)
(3)在操作②中,溶液中生成少量ICl(ICl的性质类似于氯气),为消除此杂质,使碘全部游离出来,应加入适量(填序号)________溶液,反应的离子方程式______________________。
A.KIO3 B.HClO C.KI D.Br2
(4)利用碘的有机溶液得到单质I2的方法是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
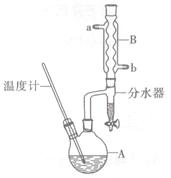
正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:
2CH3CH2CH2CH2OH (CH3CH2CH2CH2)2O+H2O
(CH3CH2CH2CH2)2O+H2O
反应物和产物的相关数据如下
| | 相对分子质量 | 沸点/℃ | 密度/(g/cm3) | 水中溶解性 |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组的同学通过课外学习了解到:某品牌牙膏中含有摩擦剂、湿润剂、表面活性剂、黏合剂、香料、甜味剂等成分,其中的摩擦剂除了含CaCO3外,可能还含有Al(OH)3、SiO2中的一种或两种。为探究该品牌牙膏中摩擦剂的成分,该小组的同学进行了如下实验(牙膏中其他成分遇到盐酸时无气体产生):
请回答下列问题:
(1)操作Ⅰ中涉及的玻璃仪器有烧杯、________、________。
(2)写出下列操作过程涉及的离子方程式:
操作Ⅲ:______________________________,
操作Ⅳ:______________________________。
(3)该摩擦剂中除CaCO3外,肯定含有__________________。
(4)为进一步探究摩擦剂中碳酸钙的含量,该小组同学利用如图所示装置(图中夹持仪器略去)进行实验。
请回答下列问题:
①实验过程中需持续缓缓通入空气。其作用除了可充分混合装置乙和丙中的反应物外,还有________的作用;
②丙中主要反应的化学方程式是________________;
③实验中准确称取4.00 g样品三份,进行三次测定,测得BaCO3的平均质量为1.97 g,计算样品中碳酸钙的质量分数(要求有计算过程):__________________________;
④有同学认为只要测定装置丙在吸收CO2前后的质量差,不必测定装置丙中生成的BaCO3质量,一样可以确定碳酸钙的质量分数。你认为该方案是否可行?________,简述理由:________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
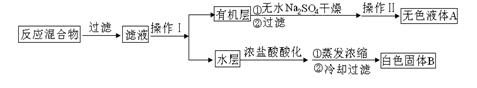
芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸。反应原理:
反应试剂、产物的物理常数:
| 名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | ∞ | ∞ |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
邻叔丁基对苯二酚(TBHQ)是一种新颖的食品抗氧剂,其制备原理如下: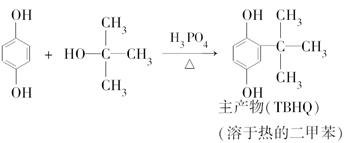
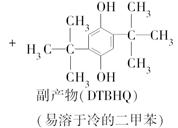
实验过程中的主要步骤如下:
步骤1:向三颈烧瓶中加入5.5 g对苯二酚,5.0 mL浓磷酸及20 mL二甲苯(装置如图所示),启动搅拌器。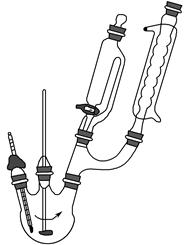
步骤2:缓缓加热到100~110 ℃,慢慢滴加7.5 mL叔丁醇和5 mL二甲苯组成的溶液,30~60 min内滴完。
步骤3:升温到135~140 ℃,恒温回流2.5 h。
步骤4:将反应液冷却到120 ℃,直到反应完成。
步骤5:将反应液倒入烧杯,并用热水洗涤三颈烧瓶,洗液并入烧杯中。
步骤6:冷却结晶,抽滤,回收滤液中的二甲苯和磷酸。
步骤7:用干甲苯重结晶、脱色、冷水洗涤、干燥。
(1)磷酸在实验中的作用是________。
(2)本实验中二甲苯的作用是_________________________________ __________________________________________________。
(3)步骤4中反应完成的标志是_________________________。
(4)步骤7脱色时,可用的脱色剂是________。
(5)对合成得到的产品表征,还需要的主要现代分析仪器是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体。继续滴加至液溴滴完,装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分析提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是 ③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须的是 (填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是 (填入正确选项前的字母)。
A.25mL B. 50mL C.250mL D.500mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com