
分析 Si与Cl两元素的单质反应生成1molCl4,恢复至室温,放热687kJ,由于该化合物的熔、沸点分别为-69℃和58℃,则常温下SiCl4为液态,以此书写热化学方程式.
解答 解:Si与Cl两元素的单质反应生成1molSi的最高价化合物SiCl4,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,则常温下SiCl4为液态,该反应的热化学方程式为Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol,
故答案为:Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
点评 本题考查热化学方程式的书写,为高频考点,把握物质的状态、反应中能量变化、焓变的正负为解答关键,侧重分析与应用能力的考查,注意化合物的熔沸点及应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | FeAl合金 | B. | ZnAl合金 | C. | CuMg合金 | D. | MgAl合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a极的电极反应为:2H2O+2e-═2OH-+H2↑ | |
| B. | 电解过程中氢氧化钾溶液的浓度保持不变 | |
| C. | b极上CrO42-发生氧化反应生成Cr2O72- | |
| D. | 电解过程中H+从右侧通过离子交换膜迁移到左侧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
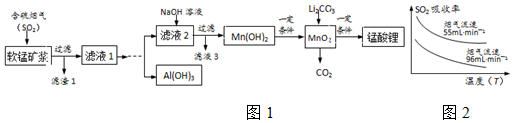
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ①②④ | C. | ②④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 25℃时,将0.2mol•L?1 CH3COOH溶液逐滴滴入25mL某浓度的NaOH溶液中,
25℃时,将0.2mol•L?1 CH3COOH溶液逐滴滴入25mL某浓度的NaOH溶液中,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,所有烷烃都呈气态 | |
| B. | 烷烃在氧气中完全燃烧,$\frac{n(C{O}_{2})}{n({H}_{2}O)}$最小的是甲烷 | |
| C. | 甲烷、乙烷、丙烷的二氯代物分别为2种、3种、4种 | |
| D. | 烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HCO3-+OH-═CO32-+H2O | |
| B. | Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | CO32-+Ca2+═CaCO3↓ | |
| D. | Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com