
【题目】水合肼(N2H4·H2O)是无色、有强碱性和强还原性的液体,是一种重要的化工试剂,某新型生产工艺设计如下:
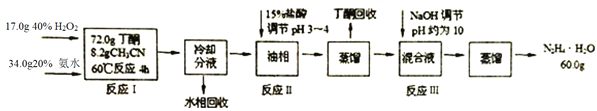
己知:①乙腈CH3CN:无色液体,与水任意比例互溶:丁酮![]() :无色液体,有毒,沸点79.6℃,密度0.81g· cm-3,在水中以1:4溶解;
:无色液体,有毒,沸点79.6℃,密度0.81g· cm-3,在水中以1:4溶解;
②反应 I 的化学方程式为:2NH3+ H2O2+![]()
![]()
![]() +4H2O
+4H2O
请回答:
(1)反应I中H2O2需逐滴滴加至混合溶液中,原因是______________________________;
(2)该新型生产工艺可将水相和丁酮回收循环使用,实现清洁化生产,水相的主要溶质成分是_____________________________;
(3)反应II加入盐酸操作的实验装置如图所示,虚线框内最为合适的仪器是_________,优点是___________。

(4)在加入足量盐酸后,肼以盐的形式存在请写出反应Ⅲ的化学方程式_________;
(5)称取水合肼馏分1.00g,加水配成2.0mL溶液,在一定条件下,用0.300mol/L的I2溶液滴定,来测定水合肼的产率。
已知:N2H4·H2O+2I2=N2↑+4HI+H2O。
①滴定时,可选用的指示剂为_________;
②实验测得消耗I2溶液的平均值为20.00mL,则N2H4·H2O的产率为_________。
【答案】 防止H2O2分解,且避免反应过于剧烈 乙腈、丁酮 C 防止盐酸(和丁酮)挥发污染环境;平衡气压,液体顺利流下 N2H4·2HCl + 2NaOH = N2H4 + 2NaCl +2H2O 淀粉溶液 90.0%
【解析】(1)如果一次性混合,反应非常剧烈,放热,可能导致H2O2分解,故分批加入。故答案为:防止H2O2分解,且避免反应过于剧烈;
(2)根据已知条件乙腈与水任意比例互溶,丁酮在水中以1:4溶解,故水相的主要溶质为乙腈和丁酮;
(3)最合适的仪器为C装置,C为恒压分液漏斗,可以平衡分液漏斗内外气压,便于液体顺利流下。故答案为:C;
(4)N2H4可写作H2N-NH2,故肼的性质可类比氨基酸中的-NH2,-NH2+ HCl→-NH2·HCl,-NH2·HCl+NaOH→-NH2+NaCl+ H2O。所以有N2H4+2HCl→N2H4·2HCl,再加NaOH,生成N2H4。故反应Ⅲ的方程式为N2H4·2HCl + 2NaOH = N2H4 + 2NaCl +2H2O;
(5)①碘的标准溶液与肼反应完全,再滴入碘的标准液后,遇淀粉变蓝色,实验滴定重点的现象为:溶液出现蓝色且半分钟内不消失,所以选择淀粉为指示剂;
故答案为:淀粉溶液;
(2)设1g馏分中水合肼的质量为a,则
N2H4·H2O + 2I2 =N2↑+4HI+H2O
50g 2mol
a 0.300mol/L×0.020L
所以![]() ,解得a=0.15g。
,解得a=0.15g。
题中一共收集到60.0g馏分,这其中N2H4·H2O的质量为:60.0g×![]() =9.0g。
=9.0g。
17.0g 40%H2O2,n(H2O2)= ![]() ,34.0g 20%氨水,n(NH3)=
,34.0g 20%氨水,n(NH3)= ![]() ,根据关系式2NH3~H2O2~1N2H4·H2O,可知N2H4·H2O的理论产量为0.2mol,质量为50g/mol×0.2mol=10.0g。
,根据关系式2NH3~H2O2~1N2H4·H2O,可知N2H4·H2O的理论产量为0.2mol,质量为50g/mol×0.2mol=10.0g。
所以,N2H4·H2O的产率为: ![]() 。
。
故答案为:90.0%


科目:高中化学 来源: 题型:
【题目】与自然界中的许多变化一样,化学反应具有方向性。下列有关叙述中正确的是
A.原电池反应一定是自发进行的氧化还原反应,且△H<0
B.ΔH<0,ΔS<0的反应肯定能自发进行
C.体系能量增大和混乱度增大都有促使反应自发进行的倾向
D.CaCO3(s) =CaO(s)+CO2(g)的ΔH>0,ΔS<0,该反应在较高温度下能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化亚铜可用作工业催化剂,是一种白色粉末,微溶于冷水,不溶于乙醇等有机溶剂,在热水中或见光都会分解,在空气中会慢慢氧化成绿色粉末。制备CuBr 的实验步骤如下:

步骤1.在如上图所示的三颈烧瓶中加入45gCuSO4·5H2O、 19gNaBr、150mL煮沸过的蒸馏水,60℃时不断搅拌,以适当流速通入SO2小时。
步骤2.溶液冷却后倾去上层清液,在避光的条件下过滤。
步骤3.依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤
步骤4.在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4h,再经氢气流干燥。最后进行真空干燥。
(1)实验所用蒸馏水需经煮沸,煮沸目的是_______________。
(2)步骤1中:
①三颈烧瓶中反应生成CuBr 的离子方程式为___________________;
②控制反应在60℃ 进行,实验中可采取的措施是__________________;
③说明反应已完成的现象是_____________________。
(3)步骤2 过滤需要避光的原因是________________________。
(4)步骤3中洗涤剂需“溶有SO2”的原因是_____________________。
(5)欲利用上述装置烧杯中的吸收液(经检测主要含Na2SO3、NaHSO3 等)制取较纯净的Na2SO3·7H2O 晶体。请补充实验步骤[须用到SO2(贮存在钢瓶2)、20%NaOH 溶液]:
①______________________。
②_______________________。
③加入少量维生素C 溶液(抗氧剂) ,蒸发浓缩,冷却结晶。
④过滤,用乙醇洗涤2~3次。⑤放真空干燥箱中干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列由乙烯推测丙烯的结构或性质不正确的是( )
A. 分子中所有原子都在同一平面上 B. 乙烯的沸点比丙烯低
C. 能与H2O、HCl发生加成反应 D. 能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示戊烷燃烧热的热化学方程式正确的是( )
A. C5H12(l)+8O2(g)![]() 5CO2(g) +6H2O(l) ΔH=-3 540 kJ·mol-1
5CO2(g) +6H2O(l) ΔH=-3 540 kJ·mol-1
B. C5H12(l)+8O2(g)![]() 5CO2(g)+6H2O(g) ΔH=-3 540 kJ·mol-1
5CO2(g)+6H2O(g) ΔH=-3 540 kJ·mol-1
C. C5H12(l)+8O2(g)![]() 5CO2(g)+6H2O(g) ΔH=+3 540 kJ·mol-1
5CO2(g)+6H2O(g) ΔH=+3 540 kJ·mol-1
D. C5H12(l)+8O2(g)![]() 5CO2(g)+6H2O(l) ΔH=+3 540 kJ·mol-1
5CO2(g)+6H2O(l) ΔH=+3 540 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:Zn(s)+![]() O2(g)=ZnO(s) △H1=–351.1 kJ/mol
O2(g)=ZnO(s) △H1=–351.1 kJ/mol
Hg(l)+![]() O2(g)=HgO(s) △H2=–90.7 kJ/mol
O2(g)=HgO(s) △H2=–90.7 kJ/mol
由此可知反应Zn(s) + HgO(s) = ZnO(s) + Hg(l) △H3 ;其中△H3的值为 ( )
A. –441.8 kJ/mol B. –254.6 kJ/mol
C. –438.9 kJ/mol D. –260.4 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为说明氯比硫的非金属性强,下列事实可作依据的是( )
A. HCl的溶解性强于H2S
B. 氯的最高价为+7价
C. H2S中的S2﹣能被Cl2氧化
D. HClO的氧化性强于H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,下列各种情况下一定能大量共存的离子组为( )
A. pH=2的溶液中:Fe2+、Cl-、Na+、NO![]()
B. 由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、CO![]() 、Cl-、K+
、Cl-、K+
C. 在能使石蕊试液变红的溶液中:NH![]() 、Cl-、Mg2+、SO
、Cl-、Mg2+、SO![]()
D. 在某无色溶液中:Fe3+、HCO![]() 、SO42-、Na+
、SO42-、Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com