
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ•mol-1 | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242 kJ•mol-1 | D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-242 kJ•mol-1 |
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:多选题
| A. | 品红溶液褪色---漂白性 | B. | 高锰酸钾溶液褪色---漂白性 | ||
| C. | 导致酸雨---酸性氧化物 | D. | 通入H2S溶液中变浑浊---氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
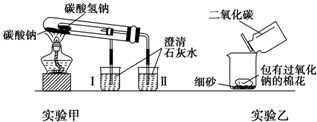
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基态碳原子核外电子排布图是: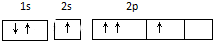 | |
| B. |  和 和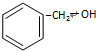 是同系物,性质相似 是同系物,性质相似 | |
| C. | 过氧化钠的电子式: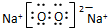 | |
| D. | 常见的化学键有:离子键、共价键、金属键、氢键等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
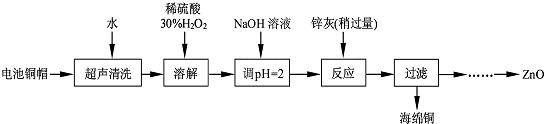
| 实验编号 | 1 | 2 | 3 | 4 |
| V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用焰色反应可以检验某些金属元素 | |
| B. | C元素和S元素在自然界中既有游离态,又有化合态 | |
| C. | SO2和Na2O2都能使紫色石蕊试液褪色,但漂白原理不同 | |
| D. | 新型陶瓷,玻璃,水泥不都是硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①⑤ | C. | ②④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com