
| A. | 核内的中子数为53 | |
| B. | 核内的电子数为135 | |
| C. | 核内的中子数与核外电子数之差为29 | |
| D. | 质量数为82 |
分析 若把原子表示为${\;}_{Z}^{A}X$,X表示元素符号,Z代表质子数,A代表质量数,质量数A=质子数Z+中子数N,核外电子数=质子数,以此分析.
解答 解:A.${\;}_{53}^{135}$Ⅰ核内中子数为135-53=82,故A错误;
B.核外电子数=质子数=53,故B错误;
C.${\;}_{53}^{135}$Ⅰ核内中子数为135-53=82,核外电子数=质子数=53,82-53=29,故C正确;
D.${\;}_{53}^{135}$Ⅰ的质量数为135,故D错误;
故选C.
点评 本题考查核素及原子的构成,明确原子中不同位置数字的意义及原子中的数量关系即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
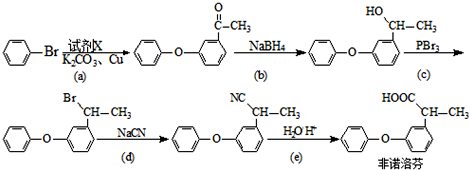
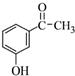 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液和醋酸铵溶液均显中性,两溶液中水的电离程度也相同 | |
| B. | 84消毒液(含NaClO)产生消毒作用的离子反应为CO2+H2O+ClO-=HClO+HCO3- | |
| C. | 在硫化钠稀溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 25℃时,将0.1mol•L-1氢氧化钠溶液与0.06mol•L-1硫酸溶液等体积混合,该混合溶液的pH等于2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
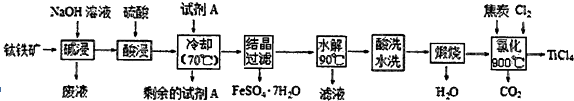
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3溶于HI溶液中:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | Na2O与水反应:O2-+H2O═2OH- | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
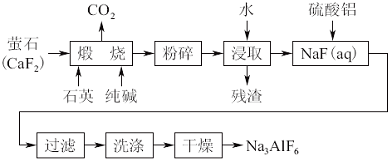
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑦ | B. | ②⑥⑦ | C. | ②④⑤⑥⑦ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑥ | B. | ②③④⑤ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com