

 =1,Cu原子的数目为:12×
=1,Cu原子的数目为:12× =3,故化学式为Cu3N,故答案为:Cu3N;
=3,故化学式为Cu3N,故答案为:Cu3N; .
.

科目:高中化学 来源: 题型:
 铜是第四周期重要的过渡元素之一,其单质及化合物具有广泛用途.
铜是第四周期重要的过渡元素之一,其单质及化合物具有广泛用途.
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)铜是第四周期重要的过渡元素之一,其单质及化合物具有广泛用途。
请回答下列有关问题:
⑴ 铜原子的基态电子排布式是 ▲ 。比较第一电离能Cu ▲ Zn(填 “>”、“=”、“<”),说明理由 ▲ 。
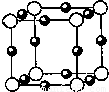
⑵氮和铜形成某种化合物的晶胞结构如图所示,则其化学式为 ▲ 。(每个球均表示1个原子)
⑶铜可以形成多种多样的配合物。
① NH3可以和很多过渡金属形成配合物。NH3分子中心原子的杂化类型为 ▲ 杂化,与NH3互为等电子体的粒子有 ▲ 。(只写其中一种)
②向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。试用离子方程式表示其原因 ▲ 、 ▲ 。
⑷在绿色植物标本的制作过程中,将植物材料洗净后浸入5%的硫酸铜溶液中,叶绿素(如图1)中心离子Mg2+被置换成Cu2+(如图2),叶片则永保绿色,请在图2中用箭头表示出配位键。
查看答案和解析>>
科目:高中化学 来源:09—10年泰州中学高二下学期期末考试化学卷 题型:填空题
(14分)铜是第四周期重要的过渡元素之一,其单质及化合物具有广泛用途。
请回答下列有关问题:
⑴铜原子的基态电子排布式是 ▲ 。比较第一电离能Cu ▲ Zn(填 “>”、“=”、“<”),说明理由 ▲ 。
⑵氮和铜形成某种化合物的晶胞结构如图所示,则其化学式为 ▲ 。(每个球均表示1个原子)
⑶铜可以形成多种多样的配合物。
① NH3可以和很多过渡金属形成配合物。NH3分子中心原子的杂化类型为 ▲ 杂化,与NH3互为等电子体的粒子有 ▲ 。(只写其中一种)
②向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。试用离子方程式表示其原因 ▲ 、 ▲ 。
⑷在绿色植物标本的制作过程中,将植物材料洗净后浸入5%的硫酸铜溶液中,叶绿素(如图1)中心离子Mg2+被置换成Cu2+(如图2),叶片则永保绿色,请在图2中用箭头表示出配位键。
查看答案和解析>>
科目:高中化学 来源:09-10年泰州中学高二下学期期末考试化学卷 题型:填空题
(14分)铜是第四周期重要的过渡元素之一,其单质及化合物具有广泛用途。
请回答下列有关问题:
⑴ 铜原子的基态电子排布式是 ▲ 。比较第一电离能Cu ▲ Zn(填 “>”、“=”、“<”),说明理由 ▲ 。
⑵氮和铜形成某种化合物的晶胞结构如图所示,则其化学式为 ▲ 。(每个球均表示1个原子)

⑶铜可以形成多种多样的配合物。
① NH3可以和很多过渡金属形成配合物。NH3分子中心原子的杂化类型为 ▲ 杂化,与NH3互为等电子体的粒子有 ▲ 。(只写其中一种)
②向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。试用离子方程式表示其原因 ▲ 、 ▲ 。
⑷在绿色植物标本的制作过程中,将植物材料洗净后浸入5%的硫酸铜溶液中,叶绿素(如图1)中心离子Mg2+被置换成Cu2+(如图2),叶片则永保绿色,请在图2中用箭头表示出配位键。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com