
分析 (1)碳酸属于多元弱酸,存在分步电离,电离过程是可逆过程;
(2)Na2CO3是强碱弱酸盐,CO32-水解导致溶液呈碱性;
(3)结合阳离子所带电荷等于阴离子所带电荷判断.
解答 解:(1)H2CO3是二元弱酸,在水溶液里分步电离,电离方程式为:H2CO3?H++HCO3-,HCO3-?H++CO32-,
故答案为:H2CO3?H++HCO3-,HCO3-?H++CO32-;
(2)Na2CO3是强碱弱酸盐,CO32-水解导致溶液呈碱性,分步水解,溶液碱性取决于第一步,水解离子方程式为:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,
故答案为:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-;
(3)阳离子所带的正电荷总数等于阴离子所带的负电荷总数,溶液Na2CO3中电荷守恒关系为:c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-),
故答案为:c(OH-)+2c(CO32-)+c(HCO3-).
点评 本题考查了电离方程式的书写、盐类的水解等知识,明确电解质的强弱及电离方程式的书写规则、盐类水解的特点是解本题关键,注意把握弱电解质的电离和结合电荷守恒解答该题,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 100mL该溶液中含0.8g NaOH | |
| B. | 200mL该溶液与100mL 0.2 mol/L的硫酸溶液反应形成中性溶液 | |
| C. | 100mL该溶液中约含0.02 mol×6.02×1023mol-1个Na+ | |
| D. | 取NaOH 8g溶于1L水中即得到1L该溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种元素均可以和氧元素形成2种或2种以上氧化物 | |
| B. | 实验室用铜和浓硝酸反应制取NO | |
| C. | CO2、SO2、NO2都能与H2O反应,且原理相同 | |
| D. | 稀硫酸、稀硝酸与铁的反应均属于置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
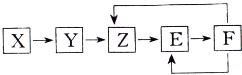 下列常见物质X、Y、Z、E、F均含有同一元素M,它们在一定条件下有如图所示的转化关系,已知Z为NO,以下有关这五种物质的推断中合理的是( )
下列常见物质X、Y、Z、E、F均含有同一元素M,它们在一定条件下有如图所示的转化关系,已知Z为NO,以下有关这五种物质的推断中合理的是( )| A. | X一定含有氮元素,可能是单质也可能是化合物 | |
| B. | X→Y一定是氧化还原反应 | |
| C. | 常温下F与碳单质反应可能生成Z | |
| D. | 若X为单质,Y→Z可能属于化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐溶液是电解质 | |
| B. | 溶液和胶体的本质区别是有无丁达尔效应 | |
| C. | 可用NaOH溶液回收铝合金中的镁 | |
| D. | 小苏打溶液呈碱性的原因:HCO3-?OH-+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁钉在空气中出现红色的铁锈,其负极反应式为:Fe-3e-═Fe3+ | |
| B. | 氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+NH4+═Mg2++NH3•H2O | |
| C. | 漂白粉溶液中加氯化亚铁溶液产生大量沉淀:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO | |
| D. | 向足量铝粉与稀盐酸反应后的溶液中滴加碳酸氢钠溶液:3HCO3-+Al3+═Al(OH)3↓+3CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下22.4L H2中含有氢分子的个数为2NA | |
| B. | 56g Fe与稀盐酸充分反应时失去的电子数为2NA | |
| C. | 44g CO2中含有氧原子的个数为2NA | |
| D. | 1L 1mol/L NaCl溶液中含有钠离子的个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com