
【题目】四氯化锡是无色液体,熔点﹣33℃,沸点114℃.氯气与金属锡在加热时反应可以用来制备SnCl4 , SnCl4极易水解,在潮湿的空气中发烟.实验室可以通过图装置制备少量SnCl4 (夹持装置略). 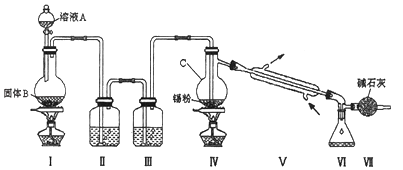
(1)仪器C的名称为:;
(2)装置Ⅰ中发生反应的离子方程式为:;
(3)装置Ⅱ中的最佳试剂为 , 装置Ⅶ的作用为;
(4)若装置连接顺序为Ⅰ﹣Ⅱ一Ⅳ一Ⅴ一Ⅵ一Ⅶ,在Ⅳ中除生成SnCl4外,还会生成的含锡的化合物的化学式为 .
(5)Ⅳ中加热的作用之一是促进氯气与锡粉反应,加热的另一作用为;
(6)若Ⅳ中用去锡粉11.9g,反应后,Ⅵ中锥形瓶里收集到23.8g SnCl4 , 则SnCl4的产率为 .
【答案】
(1)蒸馏烧瓶
(2)MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(3)饱和氯化钠溶液;防止空气中水蒸气进入Ⅵ中,SnCl4水解
(4)H2SnO3或SnO2 , 或Sn(OH)4或H4SnO4
(5)加热促使SnCl4气化,使SnCl4从反应混合物中分离出去
(6)91.2%
【解析】解:由装置图可知装置Ⅰ应为制备氯气装置,涉及离子反应为MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O,装置Ⅱ为饱和食盐水,装置Ⅲ为浓硫酸,氯气经除杂,干燥后与锡在装置Ⅳ中反应生成SnCl4 , 经冷却后在装置Ⅵ中收集,因SnCl4极易水解,应防止空气中的水蒸气进入装置Ⅵ中.(1)仪器C的名称为蒸馏烧瓶,所以答案是:蒸馏烧瓶;(2)装置Ⅰ中浓盐酸与MnO2在加热时发生反应产生氯气.发生反应的离子方程式为:MnO2+4H++2Cl﹣
Mn2++Cl2↑+2H2O,装置Ⅱ为饱和食盐水,装置Ⅲ为浓硫酸,氯气经除杂,干燥后与锡在装置Ⅳ中反应生成SnCl4 , 经冷却后在装置Ⅵ中收集,因SnCl4极易水解,应防止空气中的水蒸气进入装置Ⅵ中.(1)仪器C的名称为蒸馏烧瓶,所以答案是:蒸馏烧瓶;(2)装置Ⅰ中浓盐酸与MnO2在加热时发生反应产生氯气.发生反应的离子方程式为:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O,
Mn2++Cl2↑+2H2O,
所以答案是:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O;(3)由于盐酸有挥发性,所以在制取的氯气中含有杂质HCl,在与金属锡反应前要除去,因此装置Ⅱ中的最佳试剂为除去HCl同时还可以减少氯气消耗的饱和食盐水;SnCl4极易水解,在潮湿的空气中发烟.为了防止盐水解,所以要防止起水解.装置Ⅶ的作用为防止空气中的水蒸气进入Ⅵ中使SnCl4水解,
Mn2++Cl2↑+2H2O;(3)由于盐酸有挥发性,所以在制取的氯气中含有杂质HCl,在与金属锡反应前要除去,因此装置Ⅱ中的最佳试剂为除去HCl同时还可以减少氯气消耗的饱和食盐水;SnCl4极易水解,在潮湿的空气中发烟.为了防止盐水解,所以要防止起水解.装置Ⅶ的作用为防止空气中的水蒸气进入Ⅵ中使SnCl4水解,
所以答案是:饱和氯化钠溶液;防止空气中水蒸气进入Ⅵ中,SnCl4水解;(4)若装置连接顺序为Ⅰ﹣Ⅱ一Ⅳ一Ⅴ一Ⅵ一Ⅶ,在Ⅳ中除生成SnCl4外,在Ⅳ中除生成SnCl4外,还会生成SnCl4水解产生的含锡的化合物Sn(OH)4或SnO2 , 还会生成的含锡的化合物的化学式为 H2SnO3 (或SnO2 , 或Sn(OH)4 或 H4SnO4 ,
所以答案是:H2SnO3;或SnO2 , 或Sn(OH)4 或 H4SnO4;(5)四氯化锡是无色液体,熔点﹣33℃,沸点114℃.Ⅳ中加热的作用之一是促进氯气与锡粉反应,加热的另一作用为加热促使SnCl4气化,使SnCl4从反应混合物中分离出去,
所以答案是:加热促使SnCl4气化,使SnCl4从反应混合物中分离出去;(6)若Ⅳ中用去锡粉11.9g,则n(Sn)=0.1mol,理论上产生的SnCl4的物质的质量是m(SnCl4)=0.1mol×261g/mol=26.1g,所以反应后,若Ⅵ中锥形瓶里收集到23.8gSnCl4 , 则SnCl4的产率为 ![]() ×100%=91.2%,
×100%=91.2%,
所以答案是:91.2%.


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.标准状况下,22.4LCCl4含有C﹣Cl键的数目为4NA
B.取50mL 14.0mol/L浓硝酸与足量铜片反应,生成气体分子的数目为0.35 NA
C.反应NH4N3 ![]() 2N2↑+2H2↑,标准状况下每生成22.4LN2 , 转移电子的数目为2 NA
2N2↑+2H2↑,标准状况下每生成22.4LN2 , 转移电子的数目为2 NA
D.电解精炼铜时,若转移的电子数为NA个,则阳极质量减小32g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列四种溶液中,分别加入少量固体二氧化锰,能产生气体的是( )
A.3%H2O2溶液
B.1 mol/L NaOH 溶液
C.1 mol/L KClO3溶液
D.1 mol/L 盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下4组实验,如图Ⅰ~Ⅳ所示.
(1)Ⅱ所示的实验,若固体质量相同且稀盐酸足量时,气球鼓起较小的是(填化学式).
(2)Ⅲ、Ⅳ所示的实验均能鉴别这两种物质,相关反应的化学方程式是、 . 与Ⅲ相比,IV的优点是(填选项序号).a.Ⅳ比Ⅲ复杂 b.Ⅳ比Ⅲ安全
c.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用Ⅳ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体应该是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往100mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M.通入的CO2的体积(标准状况)与M的质量的关系如图所示.试回答下列问题:
(1)A点时,白色固体M的化学式为 , 通入的CO2的体积为mL(标准状况下,下同).
(2)C点时,白色固体M的化学式为 , 通入的CO2的体积为mL.
(3)B点时M的组成成分为(用化学式表示),通入的CO2的体积为mL.
(4)该NaOH溶液的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究FeCl3溶液中的离子平衡和离子反应,某小组同学进行了如下实验
(1)配制50mL 1.0mol·L-1 的FeCl3 溶液,测其pH约为0.7,即c(H+)=0.2mol·L-1。
①用化学用语解释FeCl3溶液呈酸性的原因:__________________。
②下列实验方案中,能使FeCl3溶液pH升高的是___________(填字母序号)。
a. 加水稀释 b. 加入FeCl3固体 c. 滴加浓KSCN溶液 d. 加入NaHCO3固体
(2)小组同学利用上述FeCl3溶液探究其与足量锌粉的反应。实验操作及现象如下:
操作 | 现象 |
向反应瓶中加入6.5 g锌粉,然后加入50mL 1.0mol·L-1 的FeCl3 溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
已知:Zn的性质与Al相似,能发生反应:Zn+2NaOH=Na2ZnO2+H2↑
①结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:_________________________。 ②用离子方程式解释反应后溶液为浅绿色的原因:______________________________。
③分离出黑色固体,经下列实验证实了其中含有的主要物质。
i. 黑色固体可以被磁铁吸引;
ii. 向黑色固体中加入足量的NaOH溶液,产生气泡;
iii. 将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv. 向iii反应后的溶液中滴加KSCN溶液,无变化。
a. 黑色固体中一定含有的物质是______________。
b. 小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4,理由是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置应用于实验室制氯气和有关氯气性质的实验,能达到实验目的是( ) 
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.装置丙:生成棕色的固体,证明Cl2有强氧化性
D.装置丁:湿润的有色布条褪色,证明Cl2有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色混合物的水溶液,只可能含有以下离子中的若干种:K+、NH ![]() 、Cl﹣、Mg2+、Fe3+、CO
、Cl﹣、Mg2+、Fe3+、CO ![]() 、SO
、SO ![]() 、H+ , 现取三份100mL溶液进行如下实验:(1)第一份加入足量AgNO3溶液有沉淀产生(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g. 根据上述实验,以下推测正确的是( )
、H+ , 现取三份100mL溶液进行如下实验:(1)第一份加入足量AgNO3溶液有沉淀产生(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g. 根据上述实验,以下推测正确的是( )
A.K+一定存在
B.100mL溶液中含0.01mol CO ![]()
C.Cl﹣一定存在
D.Fe3+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量均为3.00mol物质A,B混合于5L容器中,发生如下反应:3A+B2C,在反应过程中C的物质的量分数随温度变化如图所示: 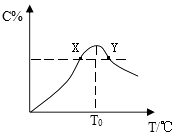
(1)T0对应的反应速率v(正)v(逆)(用“=”、“>”或“<”表示,下同);
(2)此反应的正反应为热;(填“放”或“吸”)
(3)X,Y两点A物质正反应速率的大小关系是YX;
(4)温度T<T0时,C%逐渐增大的原因是:;
(5)若Y点的C的物质的量分数为25%,则参加反应的A物质的量为mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com