
 已知,A是常见的金属单质,与B的水溶液反应生成C和D.D、F是气体单质,D在F中燃烧时产生苍白色火焰.A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出)
已知,A是常见的金属单质,与B的水溶液反应生成C和D.D、F是气体单质,D在F中燃烧时产生苍白色火焰.A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出)分析 D、F是气体单质,D在F中燃烧时发出苍白色火焰,应为氢气在氯气的燃烧,则B为HCl,C为含A的金属化合物,且可再次与F(氯气)反应为E,可知A应为变价金属,则A为Fe,C为FeCl2,D为H2,E为FeCl3,F为Cl2,据此解答.
解答 解:D、F是气体单质,D在F中燃烧时发出苍白色火焰,应为氢气在氯气的燃烧,则B为HCl,C为含A的金属化合物,且可再次与F(氯气)反应为E,可知A应为变价金属,则A为Fe,C为FeCl2,D为H2,E为FeCl3,F为Cl2.
(1)由上述分析可知,A为Fe,C为 FeCl2,故答案为:Fe; FeCl2;
(2)A为Fe,所对应的元素在周期表中的位置是:第四周期第Ⅷ族;反应②(在水溶液中进行)的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故答案为:第四周期第Ⅷ族;2Fe2++Cl2=2Fe3++2Cl-;
(3)因为Fe3++3H2O?Fe(OH)3+3H+,而Cl-不水解,所以c(Cl-)>c(Fe3+);因为水解程度很小,水解产生的c(H+)小,未水解的c(Fe3+)却很多,故c(Fe3+)>c(H+);又因为水解最后的溶液为酸性,故c(H+)>c(OH-),故离子浓度:c(Cl-)>c(Fe3+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(Fe3+)>c(H+)>c(OH-);
(4)因为FeCl3+3H2O?Fe(OH)3+3HCl,在盐酸氛围中将FeCl3溶液进行蒸发结晶,可避免FeCl3水解产生Fe(OH)3,
故答案为:盐酸;抑制FeCl3水解;
(5)因为pH=5,则c(OH-)=1×10-9,又因Fe(OH)3?Fe3++3OH-,所以有Ksp=c(Fe3+)×c3 (OH-),所以c(Fe3+)=[4.0×10-38÷(1×10-9)3]mol/L=4.0×10-11mol/L,
故答案为:4.0×10-11.
点评 本题考查无机物推断,注意根据反应现象及转化中连续反应进行推断,熟练常见元素化合物的性质,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1 mol CaC2、KHSO4、KO2(超氧化钾)三种离子化合物中,所含阴、阳离子的总数均为3NA | |
| B. | 0.1 mol C2H2OH中所含C-H键的数目为0.6NA | |
| C. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| D. | 78gNa2O2与足量水反应转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=0.1 mol•L-1的溶液:Na+、NH4+、SO42-、S2O32- | |
| B. | pH=0的透明溶液中,Na+、Fe3+、MnO4-、NO3- | |
| C. | 稀溴水中:H+、Na+、SO42-、葡萄糖分子 | |
| D. | 0.1mol•L-1的NH4HCO3溶液中:Ca2+、K+、S2-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
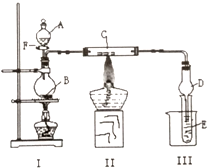 用如图所示装置进行有关实验,拔掉分液漏斗上口玻璃塞,打开F,将A逐滴加入至B中.
用如图所示装置进行有关实验,拔掉分液漏斗上口玻璃塞,打开F,将A逐滴加入至B中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成单质分子的微粒一定含有共价键 | |
| B. | 全部由非金属元素形成的化合物不一定只含共价键 | |
| C. | 离子化合物中不可能含有非极性键 | |
| D. | 非极性键只存在于双原子单质分子中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [H+]=[OH-]的溶液 | B. | pH<7的溶液 | ||
| C. | [H+]=1.0×10-7mol•L-1 的溶液 | D. | [H+]>[OH-]的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com