
 (1)在101kPa时,CO在1.0mol O2中完全燃烧,生成2.0mol CO2,放出566.0kJ的热量,则此反应的热化学方程:
(1)在101kPa时,CO在1.0mol O2中完全燃烧,生成2.0mol CO2,放出566.0kJ的热量,则此反应的热化学方程:| 1 |
| 2 |
| 1 |
| 2 |
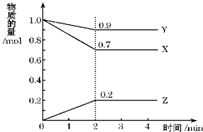
 2SO3(g),
2SO3(g),| (0.2mol/L)2 |
| (0.2mol/L)2?0.9mol/L |
| 10 |
| 9 |


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 请运用化学反应原理的相关知识研究碳及其化合物的性质.
请运用化学反应原理的相关知识研究碳及其化合物的性质.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 废铁屑(含铁锈)可用于地下水脱氮,某课题小组模拟地下水脱氮过程,并研究脱氮原理及脱氮效果.
废铁屑(含铁锈)可用于地下水脱氮,某课题小组模拟地下水脱氮过程,并研究脱氮原理及脱氮效果.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 有多种同分异构体,其中能够发生水解反应且能与氯化铁溶液发生显色反应的同分异构体有(不考虑立体异构)( )
有多种同分异构体,其中能够发生水解反应且能与氯化铁溶液发生显色反应的同分异构体有(不考虑立体异构)( )| A、6种 | B、9种 |
| C、15种 | D、19种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com