
某中性有机物C8H16O2在稀硫酸作用下加热得到M和N两种物质,N经氧化最终可得到M,
则该中性有机物的结构可能有 ( )
A.1种 B.2种 C.3种 D.4种
 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
根据下列反应,可以判断有关物质的氧化性由强到弱的顺序正确的是 ( )
①Cl2+2KI===2KCl+I2
②2FeCl2+Cl2===2FeCl3
③2FeCl3+2HI===2FeCl2+2HCl+I2
④H2S+I2===S↓+2HI
A.H2S>I2>Fe3+>Cl2 B.Cl2>Fe3+>I2>S
C.Fe3+>Cl2>H2S>I2 D.Cl2>I2>Fe3+>H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
天然维生素P(结构简式如图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述错误的是

A.可以和溴水反应
B.可用有机溶剂萃取
C.分子中有三个苯环
D.1 mol维生素P可以和4 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某单官能团有机化合物,只含碳、氢、氧三种元素,相对分子质量为58,完全燃
烧时产生等物质的量的CO2和H2O。它可能的结构共有(不考虑立体异构)
A.4种 B.5种 C.6种 D.7种
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制备1,2二溴乙烷的反应原理如下:
CH3CH2OH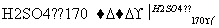 CH2===CH2
CH2===CH2
CH2===CH2+Br2—→BrCH2CH2Br
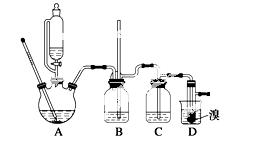
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140 ℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
有关数据列表如下:
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是________;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置 C中应加入________,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
C中应加入________,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是___________________________;
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在______层(填“上”或“下”);
(5)若产物中有少量未反应的Br2,最好用________洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液
c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用__________的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是___________________;但又不能过度冷却(如用冰水),其原因是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活是紧密相联的,下列说法正确的是
A.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰
B.海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化
C.为了增强漂白粉的使用效果,在使用漂白粉时必须和盐酸混合使用
D.今年春天,在我国南方发生了不同程度的旱情,缓解旱情的措施之一是可以用干冰或碘化银进行人工降雨
查看答案和解析>>
科目:高中化学 来源: 题型:
某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其它铁的化合物。某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究:
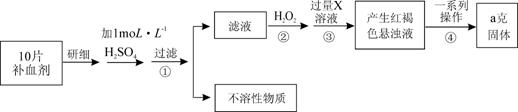 |
请回答下列问题:
Ⅰ.(1)实验时用18.4 mol·L-1的浓硫酸,配制100 mL 1 mol·L-1 H2SO4溶液,所需浓硫酸的体积为 。(计算结果精确到小数点后一位)
(2)下列操作中,容量瓶所具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来溶解固体溶质 D.常用来代替量筒量取一定体积的液体
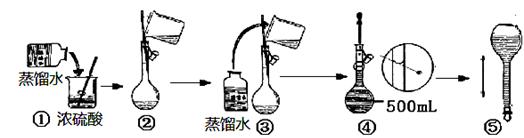 (3)在下列配制过程示意图中,有错误的是(填写序号) 。
(3)在下列配制过程示意图中,有错误的是(填写序号) 。
 | |||||
| |||||
|
(4)下列说法正确的
A.洗涤烧杯2~3次,并将洗涤液移入容量瓶以减少误差
B.某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低
C.定容时仰视观察, 所配溶液浓度会偏低
D.容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可
Ⅱ.(1)步骤②加入过量H2O2的目的: 。
(2)从红褐色的悬浊液到最后的称量,其过程中所需的基本操作为:
a. ,b. 洗涤,c. 灼烧,d. 冷却
(3)若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为 。
Ⅲ.已知人体不能很好地吸收利用Fe3+,科学研究表明服用含硫酸亚铁的补血剂时,同时服用维生素C,以利于铁元素的吸收。试分析维生素C在这一过程中的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图在试管Ⅰ中先加入3mL 95%的乙醇, 并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2mL无水乙酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管Ⅱ中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管Ⅰ小火加热3~5min后,改用大火加热,当观察到试管Ⅰ中有明显现象时停止加热。试回答:
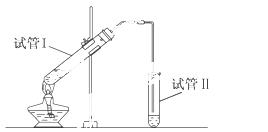
(1)试管Ⅱ中的导管不插入液面下的原因是 ;
(2)反应完毕后,振荡试管Ⅱ,观察到试管Ⅱ中的现象是 ;
(3)试管Ⅰ中加入浓硫酸的作用是 ;
(4)本实验反应开始时用小火加热的原因是 ________;(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
________;(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
(5)试管Ⅱ中饱和Na2 CO3的作用是
CO3的作用是
(6)写出试管Ⅰ中发生反应的化学方程式 
该反应的反应类型是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com