
| n |
| V |
| 1.344L |
| 22.4L/mol |
| 2 |
| n(Al) |
| 3 |
| 0.06mol |
| 2 |
| n(Al) |
| 3 |
| 0.06mol |
| 0.05mol-0.04mol |
| 0.025L |


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:

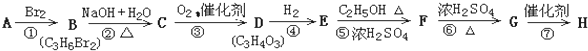
查看答案和解析>>
科目:高中化学 来源: 题型:


| 3 | 0.4 |
| 3 | 4 |
| 离子 | Fe3+ | A13+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 1.2 | 3.7 | 7.0 | 7.8 | 9.3 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| n(Fe3+) |
| n(Fe 2+) |
| n(Fe 3+) |
| n(Fe 2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
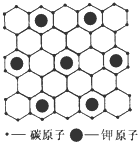 石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层碳原子中.比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CnK,其平面图形见图,则n值为( )
石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层碳原子中.比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CnK,其平面图形见图,则n值为( )| A、4 | B、6 | C、8 | D、12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 实验操作 | |
| A | 鉴别CO32-和 SO42- | 分别加入饱和CaCl2溶液 |
| B | 比较Al和Fe的金属活动性 | 分别加入浓NaOH溶液 |
| C | 比较苯酚和乙酸的酸性 | 分别加入NOH溶液 |
| D | 比较AgCl和AgI的溶解度 | 向AgCl的饱和液中加少量KI溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.5 mo1 |
| B、2.5 mo1 |
| C、3 mo1 |
| D、2 mo1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、亚硝酸不与氯化钠反应 |
| B、用HNO2溶液做导电试验,灯光较暗 |
| C、HNO2不稳定 |
| D、常温下0.1mol/L亚硝酸溶液的氢离子约为0.01mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com