
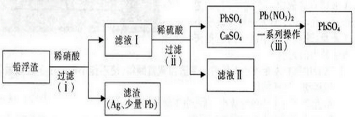
分析 铅浮渣含有Pb、Zn等,加热稀硝酸,可发生反应生成Zn(NO3)2、Pb(NO3)2,因银的还原性较弱,首先氧化Pb、Zn等,为防止银被氧化而溶解,加入硝酸不能过多,过滤后,滤液1中含有Zn(NO3)2、Pb(NO3)2、Ca(NO3)2等,加入稀硫酸,过量后得到加入PbSO4、CaSO4,进一步在滤渣中加入硝酸铅,可使部分硫酸钙转化为PbSO4,以此解答该题.
解答 解:铅浮渣含有Pb、Zn等,加热稀硝酸,可发生反应生成Zn(NO3)2、Pb(NO3)2,因银的还原性较弱,首先氧化Pb、Zn等,为防止银被氧化而溶解,加入硝酸不能过多,过滤后,滤液1中含有Zn(NO3)2、Pb(NO3)2、Ca(NO3)2等,加入稀硫酸,过量后得到加入PbSO4、CaSO4,进一步在滤渣中加入硝酸铅,可使部分硫酸钙转化为PbSO4,
(1)由以上分析可知步骤(i)中反应的氧化产物为Pb2+、Zn2+,故答案为:Pb2+、Zn2+;
(2)因银的还原性较弱,首先氧化Pb、Zn等,为防止银被氧化而溶解,加入硝酸不能过多,故答案为:防止Ag溶解;
(3)步骤(ii)中加稀硫酸,与Zn(NO3)2、Pb(NO3)2反应生成PbSO4、CaSO4,滤液Ⅱ存在硝酸,可循环使用,故答案为:HNO3;
(4)步骤(ii)中加稀硫酸不宜过多,否则滤液Ⅱ中SO42-进入HNO3与Pb2+产生PbSO4沉淀进入滤渣造成差率下降,
故答案为:滤液Ⅱ中SO42-进入HNO3与Pb2+产生PbSO4沉淀进入滤渣造成差率下降;
(5)25℃时,Ksp(CuSO4)=4.9×10-5、Ksp(PbSO4)=1.1×10-8,步骤(iii)中加入Pb(NO3)2,可使CaSO4转化为PbSO4,反应的离子方程式为CaSO4(s)+Pb2+(aq)=PbSO4(s)+Ca2+(aq),故答案为:CaSO4(s)+Pb2+(aq)=PbSO4(s)+Ca2+(aq).
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生分析及知识综合应用能力,涉及基本操作、离子反应等知识点,明确流程图中发生的反应或操作方法是解本题关键,注意基础知识的积累和灵活运用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 粗铜电解精炼时,应将粗铜与直流电源的正极相连 | |
| B. | 金属的吸氧腐蚀的过程中,正极的电极反应式为O2+4e-+2H2O═4OH- | |
| C. | 燃料电池中加入燃料的电极一定是电池的负极 | |
| D. | 在生产生活中,为保护钢铁器件免受腐蚀,应将该器件与直流电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号表示):
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
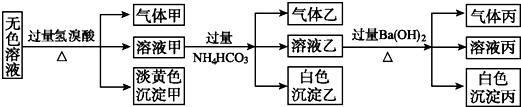
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
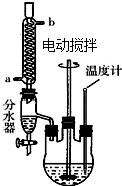 草酸二乙酯可用于苯巴比妥等药物的中间体,实验室以草酸(HOOC-COOH)和乙醇为原料制备草酸二乙酯的实验步骤如下:
草酸二乙酯可用于苯巴比妥等药物的中间体,实验室以草酸(HOOC-COOH)和乙醇为原料制备草酸二乙酯的实验步骤如下: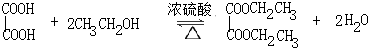 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中的金属都是以化合态形式存在的 | |
| B. | 工业上可利用反应:Mg+2KCl═MgCl2+2K↑进行金属钾的冶炼 | |
| C. | 利用潮汐发电是将化学能转化为电能 | |
| D. | 将海水蒸干可以直接获得食用盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) | |
| B. | 0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| D. | pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 甲 | 乙 |
| A | 干燥剂 | 浓硫酸、石灰石、无水氯化钙 |
| B | 电解质 | 冰醋酸、铝、水 |
| C | 酸性氧化物 | 二氧化碳、二氧化硫、三氧化硫 |
| D | 碱性氧化物 | 三氧化铁、氧化钠、氧化铝 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com