
����Ŀ�������ܡ�ͭ����Ҫ�Ĺ���Ԫ��,�仯������й㷺����;��
(1)��λ��Ԫ�����ڱ��е�____��,��̬Cu�ĺ�������Ų�ʽ��_________��Ԫ������ͭ�ĵڶ������ֱܷ�Ϊ:ICu=1958kJ/mol��IFe=1561kJ/mol��ICu>IFe��ԭ����______________��
(2)�л����������������غ���(��),��ѧʽΪ:[Fe(H2NCONH2)6](NO3)3.
�����ط�����Cԭ�ӵ��ӻ���ʽ��_______�������ǽ���Ԫ�صĵ縺���ɴ�С��˳����_____��
��[Fe(H2NCONH2)6](NO3)3�С�H2NCONH2����Fe(��)֮�����������_______�����ݼ۲���ӶԻ��������Ʋ�NO3-�Ŀռ乹��Ϊ_________��
(3)Fe3+����SCN-���飬���Ӧ���������֣��ֱ�Ϊ������(H-S-C��N)����������(H-N=C=S),���������зе�ϸߵ���________________��ԭ����________________��
(4)FeCl3����������ˮ���Ҵ����þƾ��Ƽ��ȼ����������ɴ˿�֪FeCl3�ľ�������Ϊ_____��S��Fe�γɵ�ij������侧����ͼһ��ʾ��������ʵĻ�ѧʽΪ_______��

(5)Cu����Ķѻ���ʽ��ͼ����ʾ��������Cuԭ�ӵ���λ��Ϊ_______����Cuԭ�Ӱ뾶Ϊa,����ռ�������Ϊ_______(�ú�a��ʽ�ӱ��������)��
���𰸡� ��B 1s22s22p63s23p63d104s1 ��ͭʧȥ1�����Ӻ�Ϊ3d10,���Ϊȫ����,��Խ��ȶ�,��ʧȥ���ӽ��ѣ�����ʧȥ1�����Ӻ�Ϊ3d64s1,��ʧȥ������Խ����� sp2 O��N��C��H ��λ�� ƽ�������� ��������(H-N=C=S)�� ������������γɷ��Ӽ���� ���Ӿ��� FeS 12 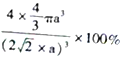
����������1���ܵ�ԭ������Ϊ27����Ԫ�������ڱ���λ�ڵ������ڵ�VIII��, Cu��ԭ������Ϊ29�� Cuԭ�ӵĻ�̬��������Ų�ʽΪ1s22s22p63s23p63d104s1�� ICu��IFe��ԭ����ͭʧȥ1�����Ӻ�Ϊ3d10�����Ϊȫ��������Խ��ȶ�����ʧȥ���ӽ��ѣ�����ʧȥ1�����Ӻ�Ϊ3d64s1����ʧȥ������Խ��ף���ȷ�𰸣�����1s22s22p63s23p63d104s1��ͭʧȥ1�����Ӻ�Ϊ3d10�����Ϊȫ��������Խ��ȶ�����ʧȥ���ӽ��ѣ�����ʧȥ1�����Ӻ�Ϊ3d64s1,��ʧȥ������Խ����ס�
��2�������ط�����Cԭ���γ�3���Ҽ���һ���м����ӻ���ʽ��sp2�������ǽ���Ԫ��Ϊ̼�������⡢����ͬһ���ڣ������ң�ԭ�Ӱ뾶��С��Ԫ�ص縺�������������ַǽ���Ԫ�صĵ縺���ɴ�С��˳����O��N��C��H ����ȷ�𰸣�O��N��C��H��
��Fe(��)�ṩ�չ��������H2NCONH2�е�����Nԭ���ṩ�µ��Ӷԣ�[Fe(H2NCONH2)6](NO3)3�С�H2NCONH2����Fe(��)֮�������������λ�������ݼ۲���ӶԻ������ۣ�NO3-����ԭ��N�ļ۲���Ӷ�Ϊ3+(5+1-2��3)/2=3���ӻ���ʽ��sp2���Ʋ�NO3���Ŀռ乹��Ϊƽ�������Σ���ȷ�𰸣���λ�� ��ƽ�������Ρ�
��3�������ᣨH-S-C��N�����������ᣨH-N=C=S���е�ϸߵ����������ᣨH-N=C=S�����÷�����Nԭ�ӵ縺�Խϴ��Ҵ���N�DH�����߱�����γɵ����������γɷ��Ӽ��������ȷ�𰸣���������(H-N=C=S)�� ������������γɷ��Ӽ������
��4��FeCl3����������ˮ���Ҵ����þƾ��Ƽ��ȼ���������˵��FeCl3�е�ͣ����Ӽ���С�����з��Ӿ�����ص�Ϊ���Ӿ��塣����ͼһ������Fe�ĸ���Ϊ4��Sԭ�ӵĸ���Ϊ8��1/8+6��1/2=4���ʸ����ʵĻ�ѧʽΪFeS����ȷ�𰸣����Ӿ��壻FeS��
��5����ͭ������һ�����ĵ�ԭ��Ϊ�۲�㣬��ƽ�����������ƽ���ϸ����ĸ�ԭ��������ԭ������Ҿ�����ȣ���12����������Cuԭ�ӵ���λ��Ϊ12��4��ͭԭ�ӵ����4��4��a3,�����ı߳�Ϊ4a����2/2,�ʿռ�������Ϊ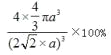 ����ȷ�𰸣�12��
����ȷ�𰸣�12��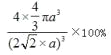 ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ�Ӻ�������Ų��������ɵ���
A.�������������������������͵ĵ��Ӳ���
B.K����������͵ĵ��Ӳ�
C.N���Ӳ�Ϊ�����ʱ���������ɵĵ�����Ϊ18
D.�����Ӳ㣨n���������ɵĵ�����Ϊn2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ͻ���һ�ֽ���װ����ϣ������м�Ӳ�����ɡ����õ����ԡ�������������Щ�����ص����� ��
A. �������� B. �ܶ�С C. �����Ժ� D. Ӳ�ȴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������NH4Al(SO4)2��12H2O���Ƿ�����ѧ���õĻ��Լ�����ҵ�ϳ�����������Ҫ�ɷ�ΪAl2O3�������������������Z��ˮ��Һ�������˿��������乤������ͼ���£�
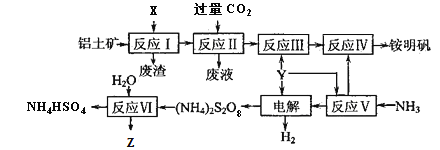
��1��д����Ӧ������ӷ���ʽ____________________��
��2��25��ʱ����0.2 mol��L-1�İ�ˮ��0.1 mol��L-1��Y��Һ�������ϣ�������Һ��pH=5������¶��°�ˮ�ĵ��볣��Kb��_____________�����Ի��ʱ��Һ����ı仯����
��3���ӷ�Ӧ�����������Һ�л������������ʵ���������Ϊ_____________��____________�����ˡ�ϴ�ӣ���������ƣ���
��4������⡱ʱ���ö��Բ������缫���������缫��ӦʽΪ__________________________��
��5����Ӧ���Ļ�ѧ����ʽΪ______________________��
��6����ˮ�к���Fe2����Mn2+�Ƚ������Ӷ���Ȼ���������ص��ƻ����ã�������(NH4)2S2O8������ȥ��д��Mn2+����������MnO2�����ӷ���ʽΪ__________________________________��ZҲ�н�ǿ�����ԣ���ʵ�������в���Z����Mn2+��ԭ����_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ϸ��������ɵ���������ȷ����
A. �Լ��ؿ������յ�������� B. DNA��RNA���ӵļ�������ͬ
C. �������ϸ������ԭ�ӵ���Ŀ��� D. ������������֬�ʵ�����Ԫ���ǵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʥ·��˹��ѧ���Ƶ������Ҵ�ȼ�ϵ�أ�ʹ���ܴ�������(H+)�Ľ������ܼ�����Ӧԭ��ΪC2H5OH+3O2��2CO2+3H2O����ͼ�Ǹõ�ص�ʾ��ͼ������˵����ȷ����

A. a��Ϊ��ص�����
B. ��ع���ʱ��������a���ص��߾������ٵ�b��
C. ��������ĵ缫��ӦΪ��4H++O2+4e-�T2H2O
D. ��ع���ʱ��1mol�Ҵ������������·����6mol����ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N4���ӽṹΪ�������壨��ͼ��ʾ������֪������N4(g)��1 molN-N������193kJ�������γ�N2(g)��1 mol N![]() N�ų�941 kJ����������˵����ȷ����
N�ų�941 kJ����������˵����ȷ����

A. N4(g)��N2(g)���ȶ�
B. N4(g)=2N2(g) ��H=+724kJmol-1
C. �γ�1 mol N4(g)�еĻ�ѧ���ų�193 kJ������
D. lmolN2(g)��ȫת��ΪN4(g)����ϵ����������362kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ�����ʾ��ȷ���ǣ�������
A.��CHO�ĵ���ʽ�� ![]()
B.������ӵı���ģ��Ϊ�� ![]()
C.2���һ���1��3������ϩ�ļ���ʽ�� ![]()
D.�������ױ��Ľṹ��ʽ�� ![]()
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com