
【题目】已知:pKa=-lgKa,25℃时 H2A 的pKa1=1.85,pKa2=7.19。常温下,用 0.1mol·L-1NaOH 溶封液滴定 20 mL 0.1 mol·L-1H2A 溶液的滴定曲线如图所示。下列说法不正确的是

A.A 点 V0﹤10 mL线
B.B 点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
C.C 点所得溶液中:c(A2-)=c(HA-)
D.D 点所得溶液中:A2-水解平衡常数Kh1=10-6.81
【答案】B
【解析】
A. A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,H2A的一级电离平衡常数为Ka1=![]() =10-1.85mol/L,所以c(H+)=Ka1,表明溶液中c(NaHA)=c(H2A),若恰好是10mL NaOH,反应起始时存在c(NaHA)=c(H2A),平衡时c(H2A)<c(NaHA),因此所加NaOH体积需<10mL,会得到平衡时c(NaHA)=c(H2A),即V0<10mL,A项正确;
=10-1.85mol/L,所以c(H+)=Ka1,表明溶液中c(NaHA)=c(H2A),若恰好是10mL NaOH,反应起始时存在c(NaHA)=c(H2A),平衡时c(H2A)<c(NaHA),因此所加NaOH体积需<10mL,会得到平衡时c(NaHA)=c(H2A),即V0<10mL,A项正确;
B. B点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHA,为第一个滴定终点,溶液中存在质子守恒,c(H2A)+c(H+)=c(A2)+c(OH),B项错误;
C. c点pH=7.19=pKa2,Ka2=c(A2)×c(H+)/c(HA)=10-7.19,所以c(A2-)=c(HA-),C项正确;
D. D点为加入NaOH溶液40mL,此时溶液中恰好生成Na2A,为第二个滴定终点,此时Na2A水解使溶液显碱性,溶液的pH为9.85,发生水解的方程式为A2+H2OHA+OH,则A2水解平衡常数Khl=![]() =
=![]() =
=![]() =10-6.81,D项正确;
=10-6.81,D项正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】磷酸氯喹是一种抗疟疾药物,研究表明该药物对新型冠状病毒2019-nCOV有较好抑制作用,以下是该药物主体氯喹的合成路线。
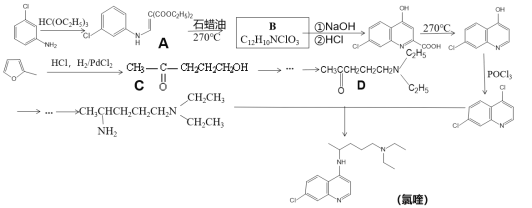
已知:①![]() 具有芳香性;
具有芳香性;
②R1-Cl+H2N-R2 → R1-NH-R2+HCl
请回答:
(1)下列说法不正确的是_________
A.氯喹具有弱碱性 B.氯喹的分子式为C18H24N3Cl
C.整个合成过程中包含了取代、加成反应 D.1molB最多可以消耗3molNaOH
(2)请写出A转化成B的化学方程式_________
(3)A转化成B的过程中还会生成一种双六元环副产物,其结构简式为_________
(4)请利用乙烯为原料将合成路线中C→D部分补充完整,用线路图表示出来(无机试剂任选)_________
(5)请写出满足下列条件的![]() 的同分异构体_________
的同分异构体_________
①1HNMR谱显示分子中只存在两种H;②分子内只存在一个环结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I是合成含六元环甾类化合物的一种中间体。利用Robinson成环反应合成I的路线如下,回答下列问题:
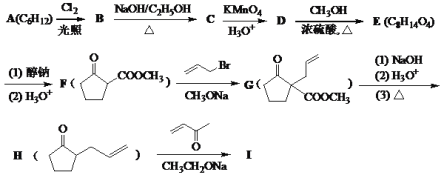
已知:①![]()
②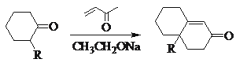
(1)B→C的反应方程式为________。
(2)化合物E和I的结构简式分别是________、________。
(3)C→D和F→G的反应类型分别是________、________。
(4)写出符合下列条件的G的同分异构体的结构简式________。
①与氢氧化钠完全反应时,二者物质的量之比为1:3;②有4种不同化学环境的氢。
(5)写出以甲醇、苯甲酸、乙酸甲酯和![]() 为原料合成
为原料合成 的合成路线(其它试剂任选)。______________________________________。
的合成路线(其它试剂任选)。______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是373K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是 ( )

A. 该反应的热化学方程式为:N2+3H2![]() 2NH3 △H=-92kJ·mol-1
2NH3 △H=-92kJ·mol-1
B. 加入催化剂,该化学反应的反应热不变
C. a曲线是加入催化剂时的能量变化曲线
D. 在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,则Q1=92
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确但不是从实验安全角度考虑的是
A. 使用稍浸入液面下的倒扣漏斗检验氢气的纯度
使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B. 使用 CCl4 萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
使用 CCl4 萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C. 吸收氨或氯化氢气体并防止倒吸
吸收氨或氯化氢气体并防止倒吸
D. 用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤气化和液化是现代能源工业中重点考虑的能源综合利用方案。最常见的气化方法为用煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH。
(1)已知:CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1
2CO(g)+O2(g)===2CO2(g) ΔH2
2H2(g)+O2(g)===2H2O(g) ΔH3
则反应CO(g)+2H2(g)===CH3OH(g)的ΔH=______。
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。
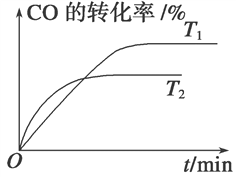
①T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。
②由CO合成甲醇时,CO在250 ℃、300 ℃、350 ℃下达到平衡时转化率与压强的关系曲线如下图所示,则曲线c所表示的温度为________ ℃。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是____________。

③以下有关该反应的说法正确的是________(填序号)。
A.恒温、恒容条件下,若容器内的压强不再发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2 mol CO和6 mol H2充入2 L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为80%
(3)一定温度下,向2 L固定体积的密闭容器中加入1 mol CH3OH(g),发生反应:CH3OH(g) ![]() CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
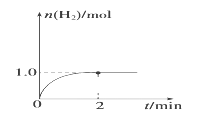
0~2 min内的平均反应速率v(CH3OH)=__________。该温度下,反应CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=__________。相同温度下,在一个恒容容器中加入一定量的CO(g)和H2发生:CO(g)+2H2(g)
CH3OH(g)的平衡常数K=__________。相同温度下,在一个恒容容器中加入一定量的CO(g)和H2发生:CO(g)+2H2(g) ![]() CH3OH(g)的反应,某时刻测得体系中各物质的量浓度如下:C(CO)=0.25 mol·L-1,C(H2)=1.0 mol·L-1,C(CH3OH)=0.75 mol·L-1,则此时该反应_____进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
CH3OH(g)的反应,某时刻测得体系中各物质的量浓度如下:C(CO)=0.25 mol·L-1,C(H2)=1.0 mol·L-1,C(CH3OH)=0.75 mol·L-1,则此时该反应_____进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组以废弃的易拉罐、漂白粉、氢氧化钠等为原料制造了一种新型环保电池,并进行相关实验,如图所示。电池的总反应方程式为2Al+3ClO-+2OH-=3Cl-+2AlO![]() +H2O。下列说法正确的是
+H2O。下列说法正确的是
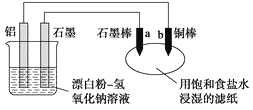
A. 电池的负极反应式为:ClO-+H2O+2e-=Cl-+2OH-
B. 当有0.1 mol Al完全溶解时,流经电解液的电子数为1.806×1023个
C. 往滤纸上滴加酚酞试液,b极附近颜色变红
D. b极附近会生成蓝色固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
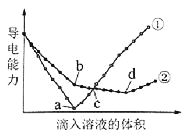
下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸奥司他韦是临床常用的抗病毒药物,常用于甲型和乙型流感治疗。其中间体结构简式如图所示,关于该有机物下列说法错误的是( )
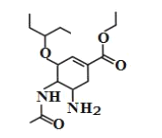
A.分子式为![]()
B.该有机物既能与酸反应又能与碱反应
C.该有机物分子中含有3个手性碳原子
D.1mol 该有机物最多能与3mol![]() 发生加成反应
发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com