
| △n |
| △t |
| 2 |
| 3 |
| 2 |
| 3 |
| △c(X) |
| △t |
| ||
| 2min |
| 5 |
| 6 |
| 5 |
| 6 |
| △n(Y) |
| V |
| 0.25mol |
| 2L |
| 0.6mol |
| 2L |
| 5 |
| 2 |


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
| A、0.5 mol Al与足量盐酸反应转移电子数为1.5NA |
| B、标准状况下,11.2 L SO3所含的分子数为0.5NA |
| C、0.5 mol CH4所含的电子数为2.5NA |
| D、46 g NO2和N2O4的混合物含有的分子数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从海水中提取物质都必须通过化学反应才能实现 |
| B、可用蘸浓盐酸的玻璃棒检验输送氨气的管道是否漏气 |
| C、碘是人体必需微量元素,所以要多吃富含高碘酸的食物 |
| D、煤经过气化和液化等物理变化可以转化为清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

 (R为烃基),则有机物A的结构
(R为烃基),则有机物A的结构 ,试写出苧烯的同分异构体(用
,试写出苧烯的同分异构体(用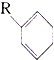 表示)与
表示)与 反应的化学方程式:
反应的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)?CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:
在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)?CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ |
| B、等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:Ca2-+2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
| C、硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液Fe2++2H++H2O2=Fe3++2H2O |
| D、淀粉碘化钾溶液在空气中变蓝4I-+O2+2H2O=2I2+4OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com